Решение задач по хими на расчет начальных и конечных концентраций в равновесной системе
Задача 361.
Константа равновесия реакции А(г) + В(г) ⇔ С(г) + D(г) равна единице. Сколько процентов вещества А подвергается превращению, если начальные концентрации [A]0 = равны 0,02 моль/л, [B]0 = 0,02; 0,1 и 0,2 моль/л?
Решение:
Уравнение реакции имеет вид: А(г) + В(г)⇔ С(г) + D(г).
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D. Следовательно, выражение для константы реакции будет иметь вид:
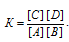
Обозначим количество прореагировавших веществ через "x". Следовательно, начальные концентрации реагирующих веществ можно записать:
A]0 = (0,02 – x)моль/л, [B]0 = (0,02 – х)моль/л,
[С]0 = x моль/л, [D]0 = x моль/л.
а) Исходные концентрации реагирующих веществ равны:
[A]0 = (0,02 – x)моль/л, [B]0 = (0,02 – х)моль/л,
[C]0 = x моль/л, [D]0 = x моль/л.
Тогда выражение для константы реакции можно записать:
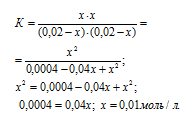
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
0,02 : 100 = 0,01 : x;
x = (0,01 . 100)/0,02 = 50%.
б) Исходные концентрации реагирующих веществ равны:
[A]0 = (0,02 – x)моль/л, [B]0 = (0,1 – х) моль/л,
[C]0 = x моль/л, [D]0 = x моль/л.
Тогда выражение для константы реакции можно записать:
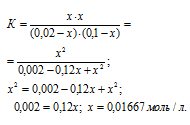
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
0,02 : 100 = 0,01667 : x;
x = (0,01667 . 100)/0,02 = 83,35%.
в) Исходные концентрации реагирующих веществ равны:
[A]0 = (0,02 – x)моль/л, [B]0 = (0,2 – х) моль/л,
[C]0 = x моль/л, [D]0 = x моль/л.
Тогда выражение для константы реакции можно записать:
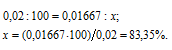
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
0,02 : 100 = 0,01818 : x;
x = (0,01818 . 100)/0,02 = 90,9%.
Ответ: а) 50%; б) 83,35%; в) 90,9%.
Задача 362.
Система:
C(графит) + СО2(г) ⇔ 2СО(г);  = 172,5 кДж находится в состоянии равновесия. Указать: а) как изменится содержание СО в равновесной смеси с повышением температуры при неизменном давлении? С ростом общего давления при неизменной температуре? б) изменится ли константа равновесия при повышении общего давления и неизменной температуре? При увеличении температуры? При введении в систему катализатора?
= 172,5 кДж находится в состоянии равновесия. Указать: а) как изменится содержание СО в равновесной смеси с повышением температуры при неизменном давлении? С ростом общего давления при неизменной температуре? б) изменится ли константа равновесия при повышении общего давления и неизменной температуре? При увеличении температуры? При введении в систему катализатора?
Решение:
Уравнение реакции имеет вид:
C(графит) + СО2(г) ⇔ 2СО(г);  = 172,5 кДж
= 172,5 кДж
а) Изменения содержания СО в равновесной смеси с повышением температуры при неизменном давлении? С ростом общего давления при неизменной температуре?
(1) Реакция протекает с поглощением теплоты, поэтому с повышением температуры при неизменном давлении, согласно принципу Ле-Шателье, равновесие системы сместится вправо, т. е. в сторону прямой реакции и концентрация СО при этом повысится.
(2) Реакция протекает с увеличением объёма газообразных веществ, поэтому при повышении общего давления в системе, согласно принципу Ле-Шателье, равновесие системы сместится влево, т.е. в сторону обратной реакции и содержание СО при этом уменьшится.
б) Изменения константы равновесия при повышении общего давления и неизменной температуре? При увеличении температуры? При введении в систему катализатора?
(1) Реакция протекает с увеличением содержания газообразных веществ, поэтому при повышении общего давления и неизменной температуре в системе, согласно принципу Ле-Шателье, равновесие системы сместится влево в сторону уменьшения общего числа молей газообразных веществ, т.е. в сторону образования СО2. Значит, константа обратной реакции будет больше константы прямой реакции ( k2 > k1) или (k1 < k2).
(2) Так как реакция протекает с поглощением теплоты, поэтому при увеличении температуры, согласно принципу
Ле-Шателье, равновесие системы сместится вправо в сторону прямой реакции, т.е. (k1 > k2).
(3) При введении в систему катализатора равновесие системы не изменится, потому что катализатор увеличит скорость как прямой, так и обратной реакции, т.е. (k1 = k2).
Ответ: а) (1) содержание СО повысится, (2) содержание СО понизится; б) (1) k1 < k2, (2) k1 > k2, (3) k1 = k2.
Задача 363.
В каком направлении сместятся равновесия:
2C(г) + О2(г) ⇔ 2СО(г);  = 556 кДж;
= 556 кДж;
N2(г) + О2(г) ⇔ 2NО(г);  = 180 кДж.
= 180 кДж.
а) при понижении температуры? б) при повышении давления?
Решение:
Уравнения реакций имеют вид:
2C(г) + О2(г) ⇔ 2СО(г);  = 556 кДж; (1)
= 556 кДж; (1)
N2(г) + О2(г) ⇔ 2NО(г);  = 180 кДж. (2)
= 180 кДж. (2)
а) При понижении температуры, согласно принципу Ле-Шателье, равновесие реакции (1) сместится вправо, так как данная реакция протекает с выделением теплоты; равновесие реакции (2) сместится влево, потому что эта реакция протекает с поглощением теплоты.
б) При повышении давления в системе, согласно принципу Ле-Шателье, равновесие реакции (1) сместится вправо, так как данная реакция протекает с уменьшением числа молей газообразных веществ; смещение равновесия реакции (2) не произойдёт, так как данная реакция протекает числа молей газообразных веществ.
Ответ: а) (1) вправо, (2) влево; б) (1) вправо, (2) не сместится.
Задача 364.
Как повлияет на равновесие следующих реакций:
H2(г) + О2(г) ⇔ 2H2O(г);  = -483,6 кДж;
= -483,6 кДж;
СаСО3(к) ⇔ СаО(к) + СО2(г);  = 179 кДж
= 179 кДж
а) повышение давления; б) повышение температуры?
Решение:
Уравнения реакций имеют вид:
H2(г) + О2(г) ⇔ 2H2O(г);  = -483,6 кДж; (1)
= -483,6 кДж; (1)
СаСО3(к) ⇔ СаО(к) + СО2(г);  = 179 кДж. (2)
= 179 кДж. (2)
а) При повышении давления в системе, согласно принципу Ле-Шателье, равновесие реакции (1) сместится вправо, так как данная реакция протекает с уменьшением числа молей газообразных веществ; равновесие реакции (2) сместится влево, так как данная реакция протекает с увеличением числа молей газообразных веществ.
б) При повышении температуры системы, согласно принципу Ле-Шателье, равновесие реакции (1) сместится влево, так как данная реакция протекает с выделением теплоты; равновесие реакции (2) сместится вправо, так как данная реакция протекает с поглощением теплоты.
Ответ: а) (1) вправо, (2) влево; б) (1) влево, (2) вправо.
Задача 365.
Указать, какими изменениями концентраций реагирующих веществ можно сместить вправо равновесие реакции C(графит) + СО2(г) ⇔ 2СО(г).
Решение:
Уравнение реакции имеет вид:
C(графит) + СО2(г) ⇔ 2СО(г).
1). Продуктом данной реакции является угарный газ, поэтому, согласно принципу Ле-Шателье, отведение из системы СО сместит равновесие системы вправо, т. е. в сторону дополнительного образования СО.
2). Увеличение концентрации исходного газообразного вещества СО2, согласно принципу Ле-Шателье, сместит равновесие системы вправо, т.е. в сторону уменьшения содержания данного вещества и при этом будет образовываться дополнительное количество СО.
Ответ: 1) уменьшение концентрации СО; 2) увеличение концентрации СО2

