Температур равновесия системы. Определение направления реакции
Температура наступления равновесия системы
Задача 10.
Термохимическое уравнение реакции: СО(г) + 2H2(г) = CH3OH(ж) + 128 кДж.
Вычислите, при какой температуре наступает равновесие в этой системе?
Решение:
Так как при реакции выделяется тепло, то это экзотермическая реакция. При экзотермических реакциях энтальпия системы уменьшается и ∆H < 0 (Н2 < H1). Тепловые эффекты выражаются через ∆H.
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Энтропия S, так же как энтальпия Н, является свойством вещества, пропорциональным его количеству. Энтропия является функцией состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса:
∆Sх.р. = ∆S0прод. – ∆S0исх.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка (– Т∆S). При Р = const и Т = const общую движущую силу процесса, которую обозначают ∆G, можно найти из соотношения:
∆G = (Н2 – H1) – (TS2 – TS1); ∆G = ∆H – T∆S.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
В состояния равновесия:
∆G = 0 и ∆H = T∆S.
Находим ∆S. для данной системы:
S0(СО) = 197,55·10-3 кДж/моль·К;
S0(Н2) = 130,52·10-3 кДж/моль·К;
S0(СН3ОН) = 126,78·10-3 кДж/моль·К;
∆Sх.р. = 126,78·10-3-(197,55·10-3) + (2·130,52·10-3) =
= -331,81·10-3.
Из условия равновесия :
∆H = T∆S находим Т = ∆H/∆S.
Т = (-128 кДж/моль)/(-331,81·10-3 кДж/моль·К) = 385,7 K.
Ответ: при 385,7 K наступит равновесие в системе.
Определение направления протекания реакции
Задача 11.
Определить направление протекания реакции:
СН4(г) + СО2(г) ⇔ 2СО(г) + 2Н2(г) при стандартных условиях. Вычислить ∆G0298
Решение:
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования ∆Hобр продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов:
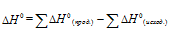
∆Нх.р. = [2∆Н(СО(г)] + [2∆Н(Н2(г)] - [∆Н(СН4(г)]+ [∆Н(СО2(г)].
т.к. ∆Н для простых веществ равна 0, то выражение принимает вид:
∆Нх.р. = [2∆Н(СО(г)] - [∆Н(СН4(г)]- [∆Н(СО2(г)];
∆Нх.р. = 2(-110,53)-(-74,85)-(-393,51) = 247,3 кДж/моль.
Энтропия - функция состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2)состояния и не зависит от пути процесса:
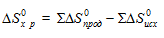
∆Sх.р. =
= [2∆S(СО(г)] + [2∆S(Н2(г)] - [∆S(СН4(г)] + [∆S(СО2(г)] =
= 2(197,55) + 2(130,52) - 186,27 - 213,66 = 256,26·10-3 кДж/моль·К.
∆G, можно найти из соотношения:
∆G = ∆H – T∆S.
Необходимо рассчитать возможность самопроизвольного протекания реакции при стандартных условиях (Т = 298 K), получим:
∆G = 247,3 - (298·256,26·10-3) = +170,9 кДж.
Ответ: ∆G = +170,9 кДж. Так как ∆G > 0, следовательно, при стандартных условиях невозможно протекание прямой реакции. Реакция может протекать в обратном направлении.

