Термохимические расчеты энтропии, энтальпии и энергии Гиббса
Задача 320.
В каком из следующих случаев реакция неосуществима при любых температурах: а)  H > 0,
H > 0,  > 0; 6)
> 0; 6)  H > 0,
H > 0,  < 0; в)
< 0; в)  H < 0,
H < 0,  <0?
<0?
Решение:
а) При  H > 0,
H > 0, > 0 в уравнении
> 0 в уравнении  =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь отрицательное значение, поэтому член (
) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (
) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член ( ) может быть отрицателен только при очень высоких значениях температуры (Т). Реакция возможна только при достаточно высоких температурах, потому что с ростом члена (Т) будет наблюдаться уменьшение значения члена (
) может быть отрицателен только при очень высоких значениях температуры (Т). Реакция возможна только при достаточно высоких температурах, потому что с ростом члена (Т) будет наблюдаться уменьшение значения члена (  ).
).
б) При  H > 0,
H > 0, < 0 в уравнении
< 0 в уравнении  =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь положительное значение при любых значениях температуры (Т). Так как
) будет иметь положительное значение при любых значениях температуры (Т). Так как  H > 0, то при положительном значении члена (T
H > 0, то при положительном значении члена (T ) значение члена (
) значение члена ( ) будет иметь положительное значение при любых значениях (Т), т.е. реакция невозможна при любых температурах
) будет иметь положительное значение при любых значениях (Т), т.е. реакция невозможна при любых температурах
в) При  H < 0,
H < 0,  < 0, реакция возможна при условии, что член
< 0, реакция возможна при условии, что член  H в уравнении
H в уравнении  =
=  H - T
H - T больше по абсолютному значению, чем член (T
больше по абсолютному значению, чем член (T ); поскольку абсолютное значение члена (T
); поскольку абсолютное значение члена (T ) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
Ответ: б).
Задача 321.
Если  H < О и
H < О и  < 0, то в каком из случаев реакция может протекать самопроизвольно: а) [
< 0, то в каком из случаев реакция может протекать самопроизвольно: а) [ H ] > [T
H ] > [T ]; б) [
]; б) [  H] < [T
H] < [T ]?
]?
Решение:
При  < 0 в уравнении
< 0 в уравнении  =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь положительное значение при любых температуры (Т), поэтому реакция возможна при условии, что член (
) будет иметь положительное значение при любых температуры (Т), поэтому реакция возможна при условии, что член ( H) в уравнении (
H) в уравнении ( =
=  H - T) больше по абсолютному значению, чем член (T
H - T) больше по абсолютному значению, чем член (T ). Если же в уравнении (
). Если же в уравнении ( =
=  H - T
H - T ) член (
) член ( H) будет иметь меньше значение, чем член (T
H) будет иметь меньше значение, чем член (T ), то значение члена (
), то значение члена ( ) всегда будет положительно, значит, реакция невозможна.
) всегда будет положительно, значит, реакция невозможна.
Таким образом, при [ H] > [T
H] > [T ] реакция может протекать самопроизвольно.
] реакция может протекать самопроизвольно.
Ответ: а).
Задача 322.
Исходя из знака  следующих реакций:
следующих реакций:
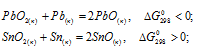
сделать вывод о том, какие степени окисленности более характерны для свинца и олова: а) для свинца +2, для олова +2; 6) для свинца +2, для олова +4; в) для свинца +4, для олова +2; г) для свинца +4, для олова +4.
Решение:
а) Для свинца +2 реакция образования PbO возможна ( < 0), для олова +2 реакция образованиям SnO невозможна (
< 0), для олова +2 реакция образованиям SnO невозможна ( > 0).
> 0).
б) Для свинца +2 реакция образования PbO возможна ( < 0), для олова +4 реакция образованиям SnO2 возможна (
< 0), для олова +4 реакция образованиям SnO2 возможна ( < 0).
< 0).
в) Для свинца +4 реакция образования PbO2 невозможна ( > 0), для олова +4 реакция образованиям SnO2 невозможна (
> 0), для олова +4 реакция образованиям SnO2 невозможна ( > 0).
> 0).
г) Для свинца +4 реакция образования PbO2 невозможна ( > 0), для олова +4 реакция образованиям SnO2 возможна (
> 0), для олова +4 реакция образованиям SnO2 возможна (  < 0).
< 0).
Вывод: более характерны для свинца и олова степени окисления соответственно +2 и +4, так как реакции образования PbO и SnO2 могут протекать самопроизвольно при стандартных условиях, имеют отрицательное значение энергии Гиббса ( < 0).
< 0).
Ответ: б).
Задача 323.
Каков знак  процесса таяния льда при 263 К: а)
процесса таяния льда при 263 К: а)  > 0; б)
> 0; б)  > 0).
> 0).
Решение:
При переходе воды из кристаллического состояния в газообразное система приобретает менее устойчивое состояние, т. е. энтропия её повышается (  > 0). Так как таяние льда процесс эндотермический,
> 0). Так как таяние льда процесс эндотермический,  H > 0.
H > 0.
При  H > 0,
H > 0,  > 0 в уравнении
> 0 в уравнении  =
=  H - T
H - T второй член равенства (- T
второй член равенства (- T ) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член (
) будет иметь отрицательное значение, поэтому член ( ) примет тоже отрицательное значение только при достаточно большом числовом значении (Т). Член ( ) может быть отрицателен только при очень высоких значениях температуры (Т). Но так как по условию задачи температура низкая (Т = 263 К), то член (
) может быть отрицателен только при очень высоких значениях температуры (Т). Но так как по условию задачи температура низкая (Т = 263 К), то член ( > O), т.е. процесс таяния льда при данной температуре невозможен.
> O), т.е. процесс таяния льда при данной температуре невозможен.
Ответ: а).
Задача 324.
Учитывая, что NO2(г) окрашен, а N2O4(г) бесцветен, и исходя из знака изменения энтропии в реакции 2NO2(г) = N2О4(г), предсказать, как изменится окраска в системе NO2 —N2O4 с ростом температуры: а) усилится; б) ослабеет.
Решение:
В реакции 2NO2(г) = N2О4(г) уменьшается общее число молей, а также число молей газообразных веществ, т.е. система из менее устойчивого состояния переходит в более устойчивое состояние, процесс сопровождается уменьшением энтропии ( < 0). Прямая реакция – процесс экзотермический, значит
< 0). Прямая реакция – процесс экзотермический, значит  H < 0. При
H < 0. При  H < 0,
H < 0,  < 0, реакция возможна при условии, что член
< 0, реакция возможна при условии, что член  H в уравнении
H в уравнении =
=  H - T
H - T больше по абсолютному значению, чем член T
больше по абсолютному значению, чем член T ; поскольку абсолютное значение члена T
; поскольку абсолютное значение члена T с ростом множителя Т увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций (прямой реакции), даже если при этом энтропия системы уменьшается. Но в системе NO2 —N2O4 производят повышение температуры, значит, равновесие сместится в сторону образования NO2, т.е. окраска раствора усилится.
с ростом множителя Т увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, т.е. при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций (прямой реакции), даже если при этом энтропия системы уменьшается. Но в системе NO2 —N2O4 производят повышение температуры, значит, равновесие сместится в сторону образования NO2, т.е. окраска раствора усилится.
Ответ: а).

