Определение состава и концентраций веществ в равновесной реакционной смеси
Задача 356.
Для реакции Н2(г) + Br2(г) = 2HBr(г) при некоторой температуре К = 1. Определить состав (в процентах по объему) равновесной реакционной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей Вг2.
Решение:
Уравнение реакции имеет вид:
Н2(г) + Br2(г) = 2HBr(г)
Согласно уравнению реакции из 1 моля Н2 и 1 Br2 образуется 2 моль HBr. Обозначим количество израсходованных исходных веществ через x. Тогда равновесные концентрации реагирующих веществ будут раны:
[Н2] = (3 – х) моль/л, [Br2] = (2 – х) моль/л, [HBr] = (2х) моль/л. Подставив эти значения концентраций в выражение константы равновесия реакции, рассчитаем значение x:
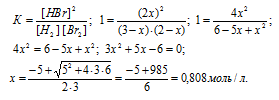
Тогда равновесные концентрации веществ будут равны:
[Н2] = 3 - 0,808 = 2,192 моль/л;
[Br2] = 2 – 0,808 = 1,192 моль/л;
[HBr] = 2 . 0,808 = 1,616 моль/л.
Находим объёмы газов в равновесной системе, учитывая, что 1 моль любого газа при нормальных условиях занимает 22,4 л, получим:
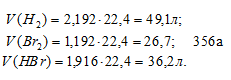
Тогда общий объём газовой равновесной системы будет равен 112 л
(49,1 + 26,7 + 36,2 = 112).
Теперь определим состав газов (в процентах по объему) равновесной реакционной смеси по формуле:
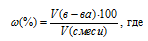
w% - объёмная доля вещества, выраженная в процентах, V(в-ва) - объём вещества, V(смеси) - общий объём газовой смеси.
Тогда
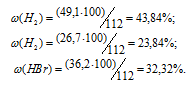
Ответ: 43,84% Н2; 23,84% Br2; 32,32%HBr.
Задача 357.
Константа равновесия реакции равна единице. Сколько процентов вещества А подвергнется превращению, если смешать З моля вещества А и 5 молей вещества В?
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) = С(г) + D(г)
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D. Обозначим равновесные концентрации веществ С и D через x. Тогда равновесные концентрации веществ будут раны: [C] = [D] = моль/л, [A] = (3 – х)моль/л, [B] = (5 – х)моль/л. Подставив эти значения концентраций в выражение кон-станты равновесия реакции, рассчитаем значение x:
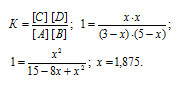
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
3 : 100 = 1,875 : x;
x = (1,875 . 100)/3 = 62,5%
Ответ: 62,5%.
Задача 358.
После смешивания газов А и В в системе А(г) + В(г) = С(г) + D(г) устанавливается равновесие при следующих концентрациях: [B] = 0,05 моль/л; [C] = 0,02 моль/л. Константа равновесия реакции равна 4.102. Найти исходные концентрации веществ А и В.
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) = С(г) + D(г) .
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D.
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моля вещества С, то такое же количество образовалось вещества D, было израсходовано по 0,02 моля веществ А и В.
Сначала найдём концентрацию вещества А из выражения для константы равновесия реакции:
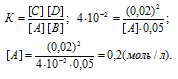
Отсюда рассчитаем искомые исходные концентрации веществ А и В:
[A]0 = 0,2 + 0,02 = 0,22 моль/л;
[B]0 = 0,05 + 0.02 = 0,07 моль/л.
Ответ: [A]0 = 0,22 моль/л; [B]0 = 0,07 моль/л.
Задача 359.
Найти константу равновесия реакции N2O4 ⇔ 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4.
Решение:
Уравнение реакции имеет вид: N2O4 ⇔ 2NO2. Из уравнения реакции следует, что из 1 моля N2O4 образуется 2 моля NO2. Поскольку по условию задачи 50% N2O4 диссоциировало, то количество N2O4, продиссоциировавшегося составляет 0,04 моль/л (0,08 . 0,5 = 0,04).
Тогда равновесные концентрации участвующих веществ будут равны:
[N2O4]0 = 0,08 – 0,04 = 0,04 моль/л;
[NO2]0 = 0,04 . 2 = 0,08 моль/л
Выражение для константы равновесия для данной реакции будет иметь вид:
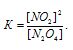
Подставляя в это выражение данные из задачи, получим:
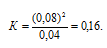
Ответ: 0,16
Задача 360.
В замкнутом сосуде протекает реакция АВ(г) ⇔ А(г) + В(г) Константа равновесия реакции равна 0,04, а равновесная концентрация вещества В составляет 0,02 моль/л. Найти начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
Решение:
Уравнение реакции имеет вид: АВ(г) ⇔ А(г) + В(г). Из уравнения реакции следует, что из 1 моля вещества АВ образуется 1 моль вещества А и 1 моль вещества В. Поскольку по условию задачи в каждом литре системы образовалось 0,02 моля вещества В, то столько же образовалось и вещества А, при этом было израсходовано 0,02 моля вещества АВ.
Константа равновесия данной реакции выражается уравнением
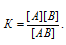
Подставляя в это выражение данные задачи, рассчитаем равновесную концентрацию вещества АВ:
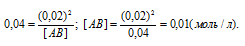
Таким образом, искомая исходная концентрация вещества АВ будет равна:
[AB]0 = 0,02 + 0,01 = 0,03 моль/л
Сколько процентов вещества АВ разложилось находим из пропорции:
0,03 : 100 = 0,02 : х;
х = (0,02 . 100)/0,03 = 66,7%
Ответ: [AB]0 = 0,03 моль/л; 66,67%.

