Расчеты, связанные с равновесием химической системы
Задача 350.
Реакция СО + С12 ⇔ СОС12 протекает в закрытом сосуде при постоянной температуре; исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остается 50% начального количества СО. Определить давление равновесной газовой смеси, если первоначальное давление равнялось 100 кПа (750 мм рт. ст.).
Решение:
Уравнение реакции имеет вид:
СО + С12 ⇔ СОС12
По условию задачи в реакцию вступило 50% СО. Из уравнения реакции следует, что из 1 моля СО и 1 моля С12 образуется 1 моль СОС12. Следовательно, из 0,5 моль СО и 0,5 моль С12 образовалось тоже 0,5 молей СОС12. Учитывая, что вещества реагируют друг с другом в эквивалентных количествах, значит, в 1л реакционной смеси содержится 2 моля исходных веществ (СО и С12), половина из которых прореагировало с образованием 0,5 молей СОС12.
Таким образом, количество системы уменьшилось на 0,5 молей и составило после протекания реакции 1,5 молей (2 – 0,5 = 1,5). Следовательно, давление равновесной газовой смеси определится из пропорции:
2 : 1,5 = 100 : х;
х = (1,5 . 100)/2 = 75 кПа.
Ответ: 75кПа.
Задача 351.
В закрытом сосуде установилось равновесие: СО2(г.) + Н2(г.) ⇔ СО(г.) + Н2О(г.); константа равновесия равна единице. Определить: а) сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2? б) в каких объемных соотношениях были смешаны СО2 и Н2, если к моменту наступления равновесия в реакцию вступило 90% первоначального количества водорода?
Решение:
а) Уравнение реакции имеет вид
СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.)
Из уравнения следует, что из 1 моля СО2 и 1 моля Н2 образуется по 1 молю СО и Н2О.
Обозначим равновесную концентрацию СО и Н2О через х, тогда [CO] = [H2O]. Таким образом, равновесные концентрации СО2 и Н2 будут составлять, соответственно, (1 – х) и (5 – х)моль/л, а СО и Н2О – по х моль/л. Подставим эти значения в выражение константы равновесия реакции:
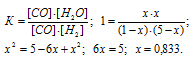
Таким образом, 83,3% СО2 подвергнется разложению в СО, учитывая, что [CO2] = 1 моль/л.
б) Находим количество Н2, которое вступило в реакцию: 5 . 0,9 = 4,5 моль/л. Остаток количества СО2 и Н2 одинаков и будет составлять 0,5 моль/л (5 – 4,5 = 0,5). Тогда объёмные соотношения СО2 и Н2, к моменту наступления равновесия, составляют:
V(H2) : V(CO2) = 4,5 : 0,5 = 9 : 1 .
Ответ: а) 83,3%; б) 9:1.
Задача 352.
При состоянии равновесия в системе:
N2(г) + 3H2(г) ⇔ 2NН3(г);  = -92,4 кДж
= -92,4 кДж
концентрации участвующих веществ равны: [N2] = 3 моль/л; [H2] = 9 моль/л; [NН3] = 4 моль/л. Определить: а) исходные концентрации Н2 и N2 б) в каком направлении сместится равновесие с ростом температуры? в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
Решение:
а) Для нахождения исходных концентраций веществ N2 и Н2 учтём, что, согласно уравнению реакции из 1 моля N2 и 3 молей Н2 образуется 2 моля NH3. Поскольку по условию задачи в каждом литре системы образовалось 4 моля NH3, то при этом было израсходовано 1/2 . 4 = 2 моля N2 и 3/4 . 4 = 6 молей Н2. Таким образом, искомые исходные концентрации N2 и Н2 равны:
[N2]0 = 3 + 2 = 5 моль/л;
[H2]0 = 6 + 3 = 9 моль/л.
б) Из уравнения реакции следует, что данная реакция экзотермическая, т.е. протекает с выделением теплоты. Поэтому при повышении температуры в экзотермической системе, согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения действия температуры, т.е. влево.
в) Реакция протекает с уменьшением числа молей газообразных веществ, т.е. с уменьшением объёма и, соответственно, с уменьшением давления в системе. Поэтому при уменьшении объёма реакционного сосуда равновесие системы сместится в сторону образования аммиака, вправо, т.е. согласно принципу Ле Шателье, в сторону уменьшения действия (повышения давления при уменьшении объёма реакционного сосуда).
Ответ: а) [N2]0 = 5 моль/л, [H2]0 = 6 + 3 = 9 моль/л; б) влево; в) вправо.
Задача 353.
Константа равновесия реакции FeO(к) + CO(г) ⇔ Fe(к) + CO2(г), при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли: [СО] = 0,05 моль/л, [СО2] = 0,01 моль/л.
Решение:
Для нахождения равновесных концентраций веществ учтем, что, согласно уравнению реакции из 1 моля СО образуется 1 моль СО2. Обозначим количество, прореагировавшего вещества СО за x моль. Учитывая, что моль СО2 образуется при реакции, то при этом равновесная концентрация СО будет равна (0,05 – х)моль/л, а СО2 – (0,01 + х) моль/л.
Таким образом, подставив в выражение константы равновесия реакции эти концентрации, найдём значение:
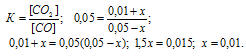
Отсюда искомые равновесные концентрации веществ равны:
[СО]равн. = 0,05 – 0,01 = 0,04 моль/л;
[СО2]равн.= 0,01 + 0,01 = 0,02 моль/л.
Ответ: [СО] = 04 моль/л; [СО2] = 0,02 моль/л.
Задача 354.
Равновесие в системе H2(г) + I2(г) ⇔ 2HI(г) установилось пи следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Решение:
Для нахождения исходных концентраций йода и водорода учтём, что согласно уравнению реакции, из 1 моля йода и 1 моля водорода образуется 2 моля йодоводорода. Поскольку по условию задачи в каждом литре системы образовалось 0,09 молей вещества HI, то при этом было затрачено 0,045 (0,09/2 = 0,045) молей H2 и, соответственно 0,045 молей I2.
Отсюда находим исходные концентрации водорода и йода:
[I2]исх. = 0,005 + 0,045 = 0.0 5моль/л;
[H2]исх. =.0,025 + 0,045 = 0,07 моль/л.
Ответ: [H2]исх. = 0,07 моль/л; [I2]исх. = 0.05 моль/л.
Задача 355.
При некоторой температуре равновесие в системе 2NO2 ⇔ 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,006 моль/л; [NO] = 0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию NO2.
Решение:
Константа равновесия данной реакции выражается уравнением:
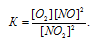
Учитывая, что равновесная концентрация О2 будет составлять 1/2 концентрации NO, т.е. 0,012 моль/л (0,024/2 = 0,012), рассчитаем константу равновесия:
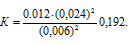
Для нахождения исходной концентрации NO2 учтём, что согласно уравнению реакции из 1 моля NO2 образуется 1 моль NO. Поскольку по условию задачи в каждом литре системы образовалось 0,024 моля NO, то при этом было израсходовано 0,024 моля NO2.
Таким образом, искомая исходная концентрация NO равна:
[NO2]исх. = 0,006 + 0,024 = 0,03 моль/л.
Ответ: К = 0,192; [NO2]исх. = 0,03 моль/л.

