Влияние значения стандартной энергии Гиббса на протекание химической реакции
Задача 312.
Вычислить значения энергии Гиббса следующих реакций восстановления оксида железа (II):
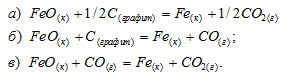
Протекание, какой из этих реакций наиболее вероятно?
Решение:
По табличным данным стандартные значения  веществ, участвующих в реакции равны:
веществ, участвующих в реакции равны:
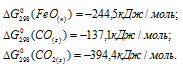
Стандартные значения  простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
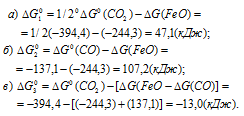
Так как  1 и
1 и  2 > 0, а
2 > 0, а  3 < 0, то наиболее вероятно протекание реакции (в).
3 < 0, то наиболее вероятно протекание реакции (в).
Ответ: а) 41,7кДж; б) 107,2кДж; в) -13,0кДж.
Задача 313.
Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: СаО, FеО, СuО, РbО, Fe2O3, Сг2O3?
Решение:
По табличным данным стандартные значения  веществ, участвующих в реакции равны:
веществ, участвующих в реакции равны:
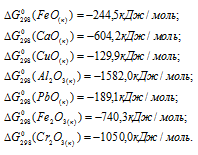
Стандартные значения  простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
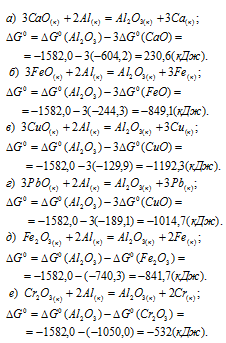
Таким образом, во всех реакциях, кроме реакции (а), значение  < 0, т. е. возможно восстановление алюминием всех оксидов, кроме СаО.
< 0, т. е. возможно восстановление алюминием всех оксидов, кроме СаО.
Ответ: Все кроме СаО.
Задача 314.
Какие из перечисленных оксидов могут быть восстановлены водородом до свободного металла при 298 К: СаО, ZnО, SnО2, NiО, А12O3?
Решение:
По табличным данным стандартные значения  веществ, участвующих в реакции равны
веществ, участвующих в реакции равны
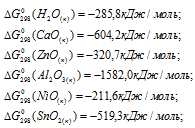
Стандартные значения  простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
простых веществ равны нулю. Отсюда, для стандартной энергии Гиббса реакций, находим:
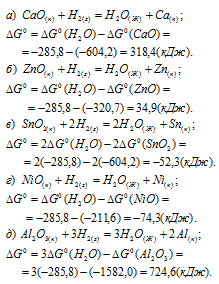
Таким образом, во всех реакциях. Кроме реакций (в) и (г), значения  больше нуля, т е. возможно восстановление водородом только оксидов SnО2 и NiО.
больше нуля, т е. возможно восстановление водородом только оксидов SnО2 и NiО.
Ответ: SnО2 и NiО.
Задача 315.
Указать, какие из реакций образования оксидов азота, и при каких температурах (высоких или низких) могут в стандартных условиях протекать самопроизвольно:
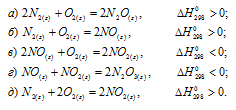
Решение:
а) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности ( < 0 ). Таким образом, в уравнении
< 0 ). Таким образом, в уравнении  =
=  Н - T
Н - T величина
величина  будет всегда положительна, так как
будет всегда положительна, так как  Н > 0 и при любых температурах член (- T
Н > 0 и при любых температурах член (- T ) всегда положителен, поэтому реакция не протекает при любых значениях температуры.
) всегда положителен, поэтому реакция не протекает при любых значениях температуры.
б) В реакции из двух молей простых газообразных веществ образуется два моля сложного вещества, что приводит систему к более низкому состоянию упорядоченности,  > 0. Таким образом, в уравнении
> 0. Таким образом, в уравнении  =
=  Н - T
Н - T член
член
( Н ) положителен, а член (- T
Н ) положителен, а член (- T ) при всех значениях Т будет иметь положительное значение, поэтому член (
) при всех значениях Т будет иметь положительное значение, поэтому член ( ) будет иметь отрицательное значение при достаточно высоких значениях температуры. Реакция может протекать при достаточно высоких температурах.
) будет иметь отрицательное значение при достаточно высоких значениях температуры. Реакция может протекать при достаточно высоких температурах.
в) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности
высокое состояние упорядоченности  < 0 ).Таким образом, в уравнении
< 0 ).Таким образом, в уравнении
( =
=  Н - T
Н - T ) член (- T
) член (- T ) при любых значениях Т будет положителен. Поэтому
) при любых значениях Т будет положителен. Поэтому  будет иметь отрицательное значение при
будет иметь отрицательное значение при  Н < 0 только при достаточно низких значениях Т, т.е. данная реакция при стандартных условиях не протекает.
Н < 0 только при достаточно низких значениях Т, т.е. данная реакция при стандартных условиях не протекает.
г) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности  < 0 ). Таким образом, в уравнении
< 0 ). Таким образом, в уравнении
( =
=  Н - T
Н - T ) член(- T
) член(- T ) при любых значениях Т будет положителен, поэтому при
) при любых значениях Т будет положителен, поэтому при  Н < 0 член
Н < 0 член  будет иметь отрицательное значение при достаточно низких температурах, т.е. данная реакция при стандартных условиях не протекает.
будет иметь отрицательное значение при достаточно низких температурах, т.е. данная реакция при стандартных условиях не протекает.
д) Реакция протекает с уменьшением, как общего числа молей веществ, так и газообразных веществ, что приводит переход системы в более высокое состояние упорядоченности  < 0 ).Таким образом, в уравнении
< 0 ).Таким образом, в уравнении
( =
=  Н - T
Н - T ) член (- T
) член (- T ) при любых значениях Т всегда будет положителен, поэтому и член
) при любых значениях Т всегда будет положителен, поэтому и член  , при
, при  Н и
Н и
(- T ) положительных, будет всегда иметь положительное значение. Реакция невозможна при любых температурах.
) положительных, будет всегда иметь положительное значение. Реакция невозможна при любых температурах.
Так как достижение низких температур нереально, то из рассмотренных реакций в обычных условиях возможна только реакция (б) да и то только при достаточно высоких температурах.
Ответ: б).

