Расчеты скорости реакции c использованием температурного коэффициента скорости реакции
Задача 336.
При 150 °С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 200 °С; б) при 80 °С.
Решение:
Согласно правилу Вант Гоффа зависимость скорости от температуры выражается уравнением:
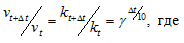
vt и kt - скорость и константа скорости реакции при температуре t°С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 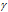 - температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4.
- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4.
а) Учитывая, что скорость химической реакции при данной температуре обратно пропорциональна продолжительности её протекания, подставим данные, приведённые в условии задачи в формулу, количественно выражающую правило Вант-Гоффа, получим:
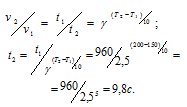
б) Так как данная реакция протекает с понижением температуры, то при данной температуре скорость этой реакции прямо пропорциональна продолжительности её протекания, подставим данные, приведённые в условии задачи в формулу, количественно выражающую правило Вант-Гоффа, получим:
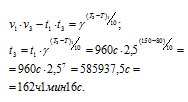
Ответ: а) при 200 °С t2 = 9,8 c; б) при 80 °С t3 = 162 ч 1мин 16 c.
Задача 337.
Изменится ли значение константы скорости реакции: а) при замене одного катализатора другим; б) при изменении концентраций реагирующих веществ?
Решение:
Константа скорости реакции – это величина, зависящая от природы реагирующих веществ, от температуры и от присутствия катализаторов, не зависит от концентрации реагирующих веществ. Она может быть равна скорости реакции в случае, когда концентрации реагирующих веществ равны единице (1 моль/л).
а) При замене одного катализатора другим изменится скорость данной химической реакции, она или увеличится. В случае применения катализатора увеличится скорость химической реакции, то, соответственно увеличится и значение константы скорости реакции. Изменение значения константы скорости реакции произойдёт и при замене одного катализатора другим, который увеличит или уменьшит скорость данной реакции по отношению к исходному катализатору.
б) При изменении концентрации реагирующих веществ изменится значения скорости реакции, а значение константы скорости реакции не изменится.
Задача 338.
Зависит ли тепловой эффект реакции от ее энергии активации? Ответ обосновать.
Решение:
Тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от промежуточных стадий процесса. Энергия активации – это избыточная энергия, которой должны обладать молекулы веществ, для того чтобы их столкновение могло привести к образованию нового вещества. Энергию активации можно изменить повышением или понижением температуры, соответственно понижая или увеличивая её. Катализаторы понижают энергию активации, а ингибиторы – понижают.
Таким образом, изменение энергии активации приводит к изменению скорости реакции, но не к изменению теплового эффекта реакции. Тепловой эффект реакции – величина постоянная и не зависит от изменения энергии активации для данной реакции. Например, реакция образования аммиака из азота и водорода имеет вид:
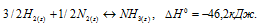
Данная реакция экзотермическая,  > 0 ). Реакция протекает с уменьшением числа молей реагирующих частиц и числа молей газообразных веществ, что приводит систему из менее устойчивого состояния в более устойчивое, энтропия уменьшается,
> 0 ). Реакция протекает с уменьшением числа молей реагирующих частиц и числа молей газообразных веществ, что приводит систему из менее устойчивого состояния в более устойчивое, энтропия уменьшается, < 0. Данная реакция в обычных условиях не протекает (она возможна только при достаточно низких температурах). В присутствии катализатора энергия активации уменьшается, и скорость реакции возрастает. Но, как до применения катализатора, так и в присутствии его тепловой эффект реакции не изменяется, реакция имеет вид:
< 0. Данная реакция в обычных условиях не протекает (она возможна только при достаточно низких температурах). В присутствии катализатора энергия активации уменьшается, и скорость реакции возрастает. Но, как до применения катализатора, так и в присутствии его тепловой эффект реакции не изменяется, реакция имеет вид:
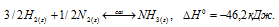
Задача 339.
Для какой реакции прямой или обратной - энергия активации больше, если прямая реакция идет с выделением теплоты?
Решение:
Разность энергий активации прямой и обратной реакций равна тепловому эффекту:  H = Ea(пр.) - Еа(обр.). Данная реакция протекает с выделением теплоты, т.е. является экзотермической,
H = Ea(пр.) - Еа(обр.). Данная реакция протекает с выделением теплоты, т.е. является экзотермической,  < 0 Исходя из этого, энергия активации прямой реакции имеет меньшее значение, чем энергия активации обратной реакции:
< 0 Исходя из этого, энергия активации прямой реакции имеет меньшее значение, чем энергия активации обратной реакции:
Ea(пр.) < Еа(обр.).
Ответ: Ea(пр.) < Еа(обр.).
Задача 340.
Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации её уменьшить на 4 кДж/моль?
Решение:
Обозначим уменьшение энергии активации через Ea, а константы скоростей реакции до и после уменьшения энергии активации соответственно через k и k'. Используя уравнение Аррениуса, получим:
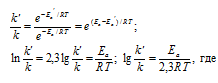
Ea - энергия активации, k и k' - константы скорости реакции, Т – температура в К (298).
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, рассчитаем увеличение скорости реакции:
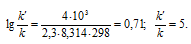
Ответ: В 5 раз.

