Сравнительная характеристика строения атомов галогенов
Валентные состояния атомов галогенов
Задача 808.
Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и йода. Какие степени окисленности проявляют галогены в своих соединениях?
Решение:
На внешнем электронном слое атомы галогенов содержат семь электронов – два на s- и пять на р-орбиталях (ns2np5). До полного завершения внешнего электронного слоя атомам галогенов не хватает одного электрона, поэтому атомы всех галогенов легко присоединяют по одному электрону, образуя однозарядные отрицательные ионы (Г-). Валентность галогенов при этом равна единице, а степень окисления равна -1.
Атомы фтора не содержат свободные d-орбитали, поэтому невозможен переход s- и р-электронов на d-орбитали. Отсюда фтор всегда в своих соединениях находится в степени окисления -1 и, при этом проявляет валентность равную единице. Остальные галогены имеют свободные d- орбитали, поэтому возможен переход одного s- и двух р-электронов на d-подуровни. Распределение электронов внешнего электронного уровня атомов фтора, хлора, брома и йода по квантовым ячейкам имеет вид:
Нормальное состояние атома фтора:
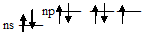
Нормальное состояние атома галогена (хлора, брома и йода):
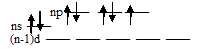
Состояние атомов галогенов (хлора, брома и йода) при возбуждении:
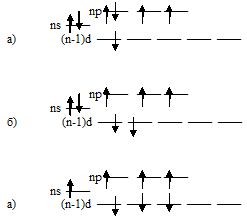
Поэтому атомы хлора, брома и йода проявляют различные степени окисления от -1 до 0, а также от +1 до +7. Характерными степенями окисления для них являются -1, 0, +3, +5, +7. Степень окисления -1 характерна для всех галогенов, так как их атомы обладают в невозбуждённом состоянии одним неспаренным электроном, который может участвовать в образовании одной связи по ковалентному механизму. Степень окисления +1 наблюдается тогда, когда атом галогена отдаёт свой единственный неспаренный р-электрон более электроотрицательному элементу, например, кислороду. Исключением является фтор, так как он самый электроотрицательный элемент. Степени окисления хлора, брома и йода в возбуждённом состоянии их атомов могут принимать значения, характеризующиеся тремя, пятью и семью неспаренными электронами (+3, +5, +7).
За исключением некоторых оксидов (ClO2, Cl2O6) галогены кроме фтора (-1), проявляют нечётные степени окисления в своих соединениях.
Сравнительная характеристика атомов галогенов
Задача 809.
Дать сравнительную характеристику атомов галогенов, указав: а) характер изменения первых потенциалов ионизации; 6) характер энергии сродства к электрону.
Решение:
а) Первые потенциалы ионизации у атомов галогенов закономерно уменьшаются с увеличением порядкового номера элемента, что свидетельствует об усилении металлических свойств. Так у фтора потенциал ионизации I равен 17,42 эВ, у хлора – 12,97 эВ, у брома – 11,48 эВ, у йода – 10,45 эВ. Эта закономерность связана с возрастанием радиусов атомов, так как с увеличение порядкового номера элемента появляются новые электронные слои. Увеличение числа промежуточных электронных слоёв, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т. е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и удаление его эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшению потенциала ионизации.
б) Энергия сродства к электрону – это энергия, выделяющаяся при присоединении к свободному атому. У атомов галогенов с ростом порядкового номера элемента сродство к электрону закономерно уменьшается в ряду: F, Cl, Br, I. У атома хлора сродство к электрону больше, чем фтора, потому что у хлора появляется на внешнем энергетическом уровне d-подуровень. Уменьшение энергии сродства к электрону с ростом заряда ядра атома объясняется ростом радиуса атома элемента и, следовательно, уменьшением при этом эффективного заряда ядра.
Сравнительная характеристика свойств галогенов
Задача 810.
Дать сравнительную характеристику свойств образуемых галогенами простых веществ, указав характер изменения: а) стандартных энтальпий диссоциации молекул Г2; б) агрегатного состояния простых веществ при обычной температуре и давлении; в) окислительно-восстановительных свойств. Назвать причины, вызывающие эти изменения.
Решение:
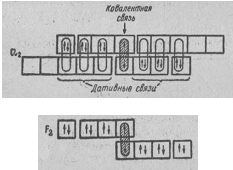
а) В ряду Cl2 — Br2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Г2 на атомы. Причины этого можно объяснить тем, что с увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается всё дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов галогенов к области перекрывания электронных облаков уменьшается. Кроме того, в ряду: Cl — Br — I возрастает число промежуточных электронных слоёв, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания электронных облаков. Однако из этих данных выпадает фтор: прочность связи между атомами фтора в молекуле F2 меньше, чем у хлора. Это можно объяснить отсутствием d-подуровня во внешнем электронном слое атома фтора. В молекулах других галогенов есть свободные d-орбитали и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь между атомами.
б) В обычных условиях фтор и хлор, газообразные вещества, бром – жидкость, а йод – кристаллическое вещество. Температуры плавления и кипения галогенов закономерно увеличиваются в ряду F — Cl — Br — I. Объясняется это тем, что с увеличением радиуса атомов возрастает Поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обуславливает возрастание температур плавления и кипения простых веществ галогенов.
в) Окислительно-восстановительные свойства галогенов закономерно изменяются в ряду F2 — Cl2 — Br2 — I2. Окислительные свойства уменьшаются в ряду галогенов от фтора к йоду, самый слабый окислитель – йод. Восстановительные свойства в ряду галогенов увеличиваются, самый слабый восстановитель – фтор. Происходит так, потому что в группе с увеличением порядкового номера элемента последовательно возрастают радиусы атомов и анионов Г- и уменьшается сродство к электрону и электроотрицательность элементов. Поэтому способность отдавать электроны увеличивается, а принимать – уменьшается в ряду
F2 — Cl2 — Br2 — I2.
Энергия диссоциации молекул галогенов
Задача 811.
Энергия диссоциации молекул галогенов по схеме Г2 ↔ 2Г составляет для фтора, хлора, брома и йода соответственно 155, 243, 190, 149 кДж/моль. Объяснить наибольшую прочность молекул хлора.
Решение:
В ряду Cl2 — Br2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Г2 на атомы. Причины этого можно объяснить тем, что с увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается всё дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов галогенов к области перекрывания электронных облаков уменьшается. Кроме того, в ряду: Cl — Br — I возрастает число промежуточных электронных слоёв, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания электронных облаков. Однако из этих данных выпадает фтор: прочность связи между атомами фтора в молекуле F2 меньше, чем у хлора. Это можно объяснить отсутствием d-подуровня во внешнем электронном слое атома фтора. В молекулах других галогенов есть свободные d-орбитали и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь между атомами. К тому же у хлора радиус атома ещё сравнительно мал, только чуть больше, чем у фтора, но значительно меньше, чем у брома и йода. Поэтому энергия связи в молекуле Cl2 значительно больше, чем у F2. Дополнительные донорно-акцепторные связи называют дативные.
Схема образования связей в молекулах F2 и Cl2: