Характеристика свойств галогенов
Задание 380.
Как изменяются окислительные свойства галогенов при переходе от фтора к йоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций:
а) Сl2 + I2 + Н2O = ; б) КI + Вг2 =.
Укажите окислитель и восстановитель.
Решение:
На внешнем электронном слое атомов галогенов содержится семь электронов (по два s-электрона и по пять р-электронов), т.е. до полного завершения внешнего энергетического уровня не хватает одного электрона. Атомы галогенов являются окислителями. Фтор – сильнейший окислитель, потому что, имея электронную конфигурацию валентного энергетического уровня 2s22p5 атом фтора способен только присоединять недостающий до полного завершения валентного уровня один единственный электрон. Атомы хлора, брома и йода имеют электронную конфигурацию внешнего уровня соответственно 3s23p5, 4s24p5, 5s25p5. Поэтому атомы Cl, Br и I тоже, как и F являются окислителями, т.е. способны оттягивать на себя электронную плотность от атомов других элементов. Окислительные свойства галогенов ослабевают от фтора к йоду. Объясняется это тем, что с увеличением заряда ядра атома возрастает число электронных подуровней атомов и, соответственно, увеличивается радиус атома, что приводит к ослаблению сил притяжения электронной плотности от атомов других элементов. Поэтому у галогенов, имеющих на внешнем энергетическом уровне семь электронов, способность оттягивать электронную плотность на себя закономерно уменьшается с ростом радиуса атомов элементов в подгруппе. Наиболее активным окислителем является фтор, а наименее активным – йод.
Уравнения реакций:
а) Сl2 + I2 + Н2O =
Уравнения электронного баланса:
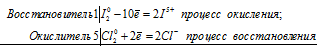
5Сl20 + I20 = 2I5+ + 10Cl-
Молекулярное уравнение реакции:
5Сl20 + I20 + 6H2O = 2HIO3 + 10HCl
В данной реакции I2 является восстановителем, потому что атомы йода увеличивают свою степень окисления от 0 до +5, а Cl2 – окислитель, потому что атомы хлора уменьшают свою степень окисления от 0 до -1.
б) КI + Вг2 =
Уравнения электронного баланса:
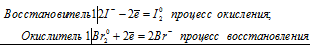
2I- +Br20 = I20 + 2Br-
Молекулярное уравнение реакции:
2KI + Br2 = I2 + 2KBr
В данной реакции КI является восстановителем, потому что атомы йода увеличивают свою степень окисления от 0=-1 до +0, а Br2 – окислитель, потому что атомы брома уменьшают свою степень окисления от 0 до -1.
Задание 381
Составьте электронные и молекулярные уравнения реакции, происходящей при пропускании хлора через горячий раствор гидроксида калия. К какому типу окислительно-восстановительных процессов относится данная реакция?
Решение:
Уравнения электронного баланса:
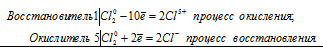
6Сl20 = 2Cl5+ + 10Cl-
После приведения членов в обеих частях равенства, получим:
3Сl20 = Cl5+ + 5Cl-
Молекулярное уравнение реакции:
3Сl20 + 6КОН = KClO3 + 5KCl + 3H2O
В данной реакции один атом хлора повышает свою степень окисления от 0 до +5 (окисляется до иона ClO3–), а пять атомов хлора понижают свою степень окисления от 0 до -1 (восстанавливаются до ионов Cl-). Реакции окисления-восстановления, в которых атомы одного и того же элемента одновременно увеличивают и уменьшают свои степени окисления, называются реакциями самоокисления-самовосстановления (диспропорционирования, дисмутации).
Задание 382.
Какие реакции нужно провести для осуществления следующих превращений:
NаСI → НСI → Сl2 → КСIО3. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
Решение:
Реакции для осуществления следующих превращений: NаСI → НСI → Сl2 → КСIО3
а) NaCl + H2SO4 (конц.) = HCl + NaHSO4
б) MnO2 + 4HCl Cl2 + MnCl2 + 2H2O
Уравнения электронного баланса:
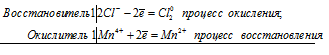
Mn4+ + 2Cl- = Mn2+ + Cl20
Молекулярное уравнение реакции:
MnO2 + 4HCl Cl2 + MnCl2 + 2H2O
Эта реакция является окислительно-восстановительной, так как марганец (MnO2) уменьшает свою степень окисления от +4 до +2, является окислителем, а атомы хлора (HCl) увеличивают свою степень окисления от -1 до 0, является восстановителем.
в) Соли HClO3 получают по реакции диспропорционирования:
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
Уравнения электронного баланса:
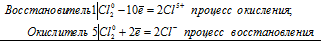
6Сl20 = 2Cl5+ + 10Cl-
После приведения членов в обеих частях равенства, получим:
3Сl20 = Cl5+ + 5Cl-
Молекулярное уравнение реакции:
3Сl20 + 6КОН = KClO3 + 5KCl + 3H2O
В данной реакции один атом хлора повышает свою степень окисления от 0 до +5 (окисляется до иона ClO3-), а пять атомов хлора понижают свою степень окисления от 0 до -1 (восстанавливаются до ионов Cl-). Реакции окисления-восстановления, в которых атомы одного и того же элемента одновременно увеличивают и уменьшают свои степени окисления, называются реакциями самоокисления-самовосстановления (диспропорционирования, дисмутации).
Задание 385.
Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции:
Кl + NaOCl + Н2SO4 ⇔ I2 +…
Хлор приобретает низшую степень окисления.
Решение:
а) Кислородные кислоты хлора: HClO – хлорноватистая кислота. Степень окисления хлора +1; HClO2 – хлористая кислота. Степень окисления хлора +3; HClO3 – хлорноватая кислота. Степень окисления хлора +5; HClO4 – хлорная кислота. Степень окисления хлора +7.
б) Более сильный окислитель из всех кислородных кислот хлора – хлорная кислота HClO4.
в) Уравнение реакции имеет вид: Кl + NaOCl + Н2SO4 ⇔ I2 +…
Уравнения электронного баланса:
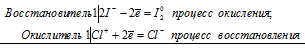
2I- + Cl+ = I20 + Cl-
Молекулярное уравнение реакции:
2Кl + NaOCl + Н2SO4 ⇔ I2 + NaCl + K2SO4 + H2O

