Степени окисления мышьяка, сурьмы и висмута
Задание 379.
Какую степень окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
Решение:
Мышьяк, сурьма и висмут имеют конфигурацию внешнего электронного слоя …ns2p3, поэтому могут проявлять степень окисления -3, +3 и +5. Для мышьяка характерными степенями окисления являются -3, +3, +5(AsH3, As2O3, H3AsO4). Для сурьмы характерными степенями являются +3, +5(SbCl3, Sb2O5). Для висмута характерной степенью окисления является +3 [соли Bi3+, особенно Bi(NO3)3].
Уравнения реакций:
а) реакция мышьяка с концентрированной азотной кислотой:
Уравнения электронного баланса:
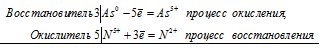
3As0 + 5N5+ = 3As5+ + 5N3+
Молекулярное уравнение реакции:
3As + 5HNO3 + 2H2O = 3Н3AsО4 + 5NO
б) реакция висмута с концентрированной серной кислотой:
Уравнения электронного баланса:
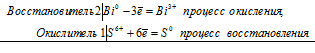
2Bi0 + S6+ = 2Bi3+ + S0
Молекулярное уравнение реакции:
2Bi+ 4H2SO4 = Bi2(SO4)3 + S↓ + 4H2O
Задание 383.
К раствору, содержащему SbCl3 и ВiСI3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
Решение:
Уравнения реакций КОН с SbCl3 и ВiСI3
Если к растворам, содержащих SbCl3 и ВiСI3, прилить избыток раствора гидроксида калия, то произойдёт образование осадков соответствующих гидроксидов сурьмы и висмута, а также хлорида калия:
а) 3КОН + SbCl3 = Sb(OH)3↓ + 3KCl (молекулярная форма):
Sb3+ + 3OH- = Sb(OH)3↓ (ионно-молекулярная форма).
б) 3КОН + ВiСI3 = Bi(OH)3↓+ 3KCl (молекулярная форма):
Bi3+ + 3OH- = Bi(OH)3↓ (ионно-молекулярная форма)
Так как КОН взят в избытке, то амфотерный гидроксид сурьмы (III) Sb(OH)3 будет растворяться в избытке КОН с образованием комплексного иона [Sb(OH)6]3-:
в) Sb(OH)3 + 3KOH = K3[Sb(OH)6]
Суммировав уравнение (а) и (в) получим:
г) SbCl3 + 6KOH = K3[Sb(OH)6] + 3KCl (молекулярная форма);
д) Sb3+ + 3OH- = [Sb(OH)6]3- (ионно-молекулярная форма)
Таким образом, при действии на растворы SbCl3 и ВiСI3 избытком КОН образуются растворимое комплексное соединение K3[Sb(OH)6] (в случае с SbCl3) и нерастворимый гидроксид висмута (III) Bi(OH)3.

