Изменение кислотно-основных свойств гидроксидов металлов главной подгруппы II группы в ряду Ве(ОН)2 — Ва(ОН)2
Гидроксиды металлов главной подгруппы 2-й группы
Задача 1006.
Как и почему изменяются основные свойства гидроксидов металлов главной подгруппы II группы в ряду Ве(ОН)2 — Ва(ОН)2?
Решение:
Подобная закономерность обусловлена увеличением в группе радиусов ионов при постоянном их заряде за счёт прибавления электронных слоев следует увеличение радиуса атома и иона. Ве(ОН)2 - амфотерный гидроксид, Mg(OH)2 - слабое нерастворимое основание, Ca(OH)2 - основание (щелочь), Sr(OH)2 - сильное основание (щелочь), Ва(ОН)2 – сильное основание (щелочь).
Это можно объяснить с использованием схем Косселя. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э—Н и Э—О—Н, в зависимости от заряда ядра и радиуса образующего их элемента. Рассмотрим схему для Ве(ОН)2 и Ва(ОН)2:
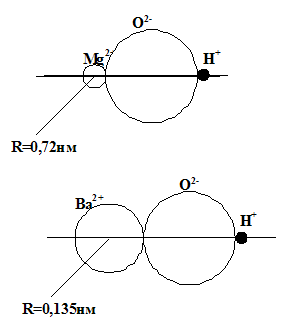
Рис. 1. Схема Косселя для Mg(ОН)2 и Ва(ОН)2
Как видно из представленной схемы, радиус иона Mg2+ меньше радиуса иона Ba2+ и ОН− – группа связана прочнее с катионом бария, чем с катионом магния. В результате Ва(ОН)2 будет легче диссоциировать в растворе и основные свойства гидроксида бария будут выражены сильнее, чем гидроксида магния.
Диагональное сходство бериллия и алюминия
Задача 1007.
В чем проявляется сходство химических свойств бериллия и алюминия? Чем объясняется это сходство?
Решение:
По своим химическим свойствам бериллий в значительной степени сходен с алюминием (бериллий и алюминий являются амфотерными элементами), находящимся в третьем периоде и в третьей группе периодической системы, т. е. правее и ниже бериллия. Это явление, носящее название диагонального сходства, наблюдается не только у бериллия и алюминия, но так же у лития и магния, натрия и кальция. У бериллия и у алюминия ионные потенциалы Z/R, где Z – заряд иона, R – радиус иона, следует ожидать близкие значения. Действительно, ионные потенциалы для ионов бериллия и алюминия, будут равны 2/0,34 = 5,88 и 3/0,51 = 5,88. Близость ионных потенциалов приводит к близким свойствам самих соединений. При близких значениях ионных потенциалов следует ожидать примерно одинакового поляризующего действия катионов на однотипные анионы. В этом случае физико-химические характеристики разных соединений могут оказаться близкими. Энтальпии образования характеристических оксидов ВеО -598 кДж/моль и Al2O3 -1676,8 кДж/моль, металлические свойства обеих элементов близки (бериллий и алюминий при хранении на воздухе покрываются плотной оксидной плёнкой и др.).

