"Химия. 9 класс". О.С. Габриелян (гдз)
Способы получения соляной кислоты и изучение ее свойств
Получение соляной кислоты (НСl)
а) Будучи нелетучей сильной кислотой, H2SO4 способная вытеснять другие кислоты из их солей. В данном случае НСl также сильная кислота, но она обладает летучими свойствами. Поэтому для ее получения используют реакцию при нагревании.
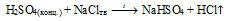
В сильно кислой среде средняя соль Na2SO4 переходит в кислую NaHSO4:
Na2SO4 + H2SO4 ↔ 2NaHSO4.
Без нагревания в растворе устанавливается ионное равновесие. Хлороводород не выделяется.
NaCl + H2SO4 ↔ NaHSO4 + HCl.
2) Раствор хдороводорода немного тяжелее воды, поэтому мы можем наблюдать тонкие опускающиеся струйки еще не перемешавшейся, только что образовавшейся при растворении соляной кислоты.
3) Хдороводород очень хорошо растворим в воде. Если конец газоотводной трубки опустить низко к поверхности воды, то может произойти всасывание раствора в трубку.
Посмотрите рис. 18 из учебника (стр. 83), иллюстрирующий хорошую растворимость хлороводорода в воде.
Изучение свойств соляной кислоты
Для изучения свойств соляной кислоты проведем несколько характерных для нее реакций.
1) Не все металлы реагируют с соляной кислотой. Идет реакция, или нет зависит от активности металла. Чем активней металл, тем быстрее идет взаимодействие. Для удобства можно рассмотреть электрохимический ряд напряжений металлов (он находится на форзаце в конце учебника). Тогда металлы, находящиеся перед Н2, реагируют с кислотами, после Н2 — не реагируют.
Поэтому Zn и Mg вытесняют Н2 из кислоты:
Zn + 2НСl ↔ ZnCl2 + H2↑;
Mg + 2НСl ↔ MgCl2 + H2↑.
С медью соляная кислота не реагирует.
2) В четвертой пробирке протекает реакция:
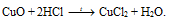
СuO растворяется в кислоте, образуется голубой раствор за счет окрашенных ионов Сu2+.
В пятой пробирке происходит растворение Сu(OH)2 в НСl.
Сu(OH)2 + 2HCl ↔ CuCl2 + 2H2O.
Также образуется голубой раствор (Сu2+). В шестой пробирке:
CaCO3 + 2HCl ↔ CaCl2 + H2O + CO2↑.
Более сильная соляная кислота вытесняет из карбоната сальция более слабую угольную кислоту, которая разлагается на углекислый газ и воду:
Н2СО3 ↔ H2O + CO2↑
3) Сначала запишем все реакции с АgNO3.
HCl + AgNO3 ↔ AgCl↓ + HNO3;
NaCl + AgNO3 ↔ AgCl↓ + NaNO3;
CaCl2 + 2AgNO3 ↔ 2AgCl↓ + Ca(NO3)2.
Во всех пробирках выпадает белый осадок, не растворимый в концентрированной азотной кислоты. Аналогично происходят реакции с нитратом свинца (II).
2HCl + Pb(NO3)2 ↔ PbCl2↓ + 2HNO3;
2NaCl + Pb(NO3)2 ↔ PbCl2↓ + 2NaNO3;
CaCl2 + Pb(NO3)2 ↔ PbCl2↓ + Ca(NO3)2.
Так как растворимость PbCl2 все-таки достаточно велика, то осадок выпадает лишь из достаточно концентрированных растворов. При добавлении избытка концентрированной HNO3 концентрация ионов Pb2+ и Сl– уменьшается, кроме того, равновесие из-за избытка HNO3 смещается влево, поэтому осадок PbCl2 растворяется.
а) Для того, чтобы отличить соляную кислоту от других кислот, можно провести реакцию с АgNO3 или Pb(NO3)2. В результате выпадает белый творожистый осадок АgCl или малорастворимый PbCl2.
б) Хлориды определяются иным образом.
в) Соляную кислоту от хлоридов можно отличить реакцией с металлами. HCl реагирует с металлами, выделяя газообразный водород.

