"Химия. 9 класс". О.С. Габриелян (гдз)
Качественные реакции на ноны металлов
Определение ионов кальция, алюминия и железа
Здание 1.
В химии исход реакции часто зависит от условий его проведения, например, от соотношения реагентов. При добавлении к раствору АIСl3, щелочи выпадает осадок гидроксида, так как щелочь в этом случае в недостатке:
AlCl3 + 3NaOH(недостаток) ↔ Al(OH)3↓ + 3NaCl.
При добавлении к щелочи раствора А1Сl3, осадок не выпадает, т.к. Аl(ОН)3, сразу же реагирует с избытком NаОН до образования гидроксокомплекса (гексагидроксоалюмината натрия):
AlCl3 + 3NaOH(избыток) ↔ Na3[Al(OH)6] + 3NaCl.
Задание 2.
Для подтверждения качественного состава СаС2, добавим к его раствору карбонат натрия. При этом выпадет белый осадок. Приведем уравнения реакций процесса:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl (молекулярное уравнение);
Ca2+ + 2Cl– + 2Na+ + CO3– = CaCO3↓ + 2Na+ + 2Cl– (полное ионно-молекулярное уравнение реакции);
Ca2+ + CO3– = CaCO3↓ (сокращенное ионо-молекулярное уравнение).
Для определения ионов Cl– в образце можно использовать раствор АgNO3, который дает нерастворимый белый осадок. Приведем уравнения реакций процесса:
CaCl2 + 2AgNO3 ↔ Ca(NO3)2 + 2AgCl↓ (молекулярное уравнение);
Ca2+ + 2Cl– + 2Ag+ + 2NO3– ↔ Ca2+ + 2NO3– + 2AgCl↓ (полное ионно-молекулярное уравнение реакции);
Ag+ + Cl– ↔ AgCl↓ (сокращенное ионо-молекулярное уравнение).
Задание 3.

Задание 4.
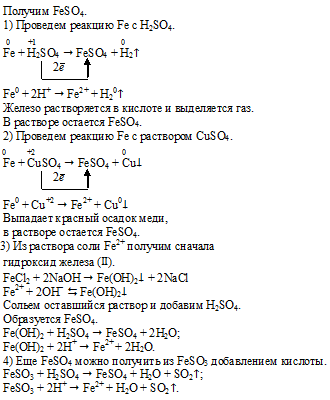
Задание 5.


