"Химия. 9 класс". О.С. Габриелян (гдз)
Экспериментальные задачи по распознаванию и получению веществ
Обнаружение ионов бария, алюминия, железа
Вариант 1.
В выданных пробирках содержатся твердые белые вещества. Для начала растворим их в воде. Добавим к полученным растворам раствор Н2SO4:
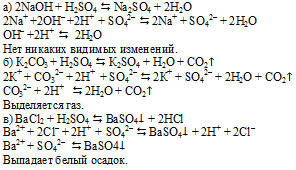
Вариант 2.
В пробирках содержатся твердые белые вещества. Сначала их растворим в воде. а) В одной пробирке вещество не будет растворяться. Это СаСО3. Для окончательной проверки добавим к нему раствор HCl.

Вариант 3.
В пробирках — твердые белые вещества. Попытаемся их растворить в воде. Не растворившееся вещество в одной из пробирок — зто СаСО3.
Для подтверждения можно добавить к нему раствор кислоты (смотри вариант 2(а)). Для определения Na2SO4 проведем аналогичный опыт, как и в варианте 2(б).
В оставшейся пробирке находится Ва(NO3)2. Для подтверждения к нему можно прилить раствор серной кислоты, выпадет белый осадок:
Ва(NO3)2 + H2SO4 ↔ BaSO4↓ + 2HNO3
Ba2+ + 2NO3– + 2H+ + SO42– ↔ BaSO4↓ + 2H+ + 2NO3–
Ba2+ + SO42– ↔ BaSO4↓
Вариант 4.
В пробирках — три различных раствора. Добавим к каждой из трех пробирок немного раствора NaОН.
а) В пробирке, где нет видимых изменений, содержится NaСI.
б) В пробирке с раствором АlСl3 выпал белый студенистый осадок, растворимый как в кислотах, так и в щелочах:

Задача 1.
Для определения примеси сульфата железа (III) в железном купоросе воспользуемся качественной реакцией на ион Fe3+, т.е. проведем реакцию с желтой кровяной солью:
2Fe2(SO4)3 + 3K4[Fe(CN)6] ↔ Fe4[Fe(CN)6]3↓ + 6K2SO4.
Если примесь ионов Fe3+ содержится в купоросе, то выпадет темно-синий осадок турнбулевой соли (берлинская лазурь).
Задача 2.
Для начала переведем FeCl3, в гидроксид, добавляя раствор NаОН. Идет реакция:
FeCl3 + 3NaOH ↔ Fe(OH)3↓ + 3NaCl.
Выпадает бурый осадок гидроксида. Теперь сольем с него раствор по возможности, а сам осадок перенесем в фарфоровый тигль и прокалим на огне. Оставшийся порошок цвета ржавчины и будет Fe2O3.
Задача 3.
Для получения алюмината натрия необходимо к Аl добавить избыток раствора NаОН и подождать некоторое время.
Алюминий на воздухе покрывается оксидной пленкой, которая медленно растворяется в щелочи. Сам же алюминий со щелочью реагирует довольно активно.
Запишем все происходящие реакции:
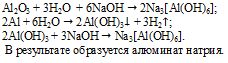
Задача 4.
Для получения FeCl2 проведем реакцию между Fe и раствором НСl:
Fe + 2HCl ↔ FeCl2 + H2↑

