"Химия. 9 класс". О.С. Габриелян (гдз)
Экспериментальные задачи по теме «Подгруппа кислорода»
Определение веществ, вытеснение водорода
Задача 1.
Для доказательства проведем сначала реакцию серной кислоты с Zn:
Zn + H2SO4 ↔ ZnSO4 + H2↑.
Цинк вытесняет водород из кислоты, т.е. H2SO4 содержит ионы водорода. Проведем реакцию H2SO4 с раствором соли ВаCl2:
ВаCl2 +H2SO4 ↔ BaSO4↓ + 2HCl.
Выпадает белый осадок, не растворимый в кислотах и основаниях, т.е. H2SO4 содержит ноны SO42–.
Задача 2.
В реакции цинка с разбавленной серной кислотой выделается водород:
Zn + H2SO4(разб.) ↔ ZnSO2 + H2↑.
При реакции Zn с концентрированной серной кислотой выделяется H2S, обладающий неприятным характерным запахом.
4Zn + 5H2SO4(конц.) ↔ 4ZnSO4 + H2S↑ + 4H2O.
Разбавленная серная кислота реагирует с металлами, как обычная минеральная кислота. Концентрированная серная кислота ведет себя уже как кислота-окислитель, в результате реакция происходит по другому.
Задача 3.
Хлорная и бромная вода — окислители, поэтому в обеих пробирках сульфид окислится до серы.
Na2S + Cl2 = S + 2NaCl;
Na2S + Br2 = S + 2NaBr.
Растворы обесцвечиваются.
Задача 4.
У нас есть три различных вещества: HCl; H2SO4; NaОН.
1) Для определения NaОН можно использовать лакмус (индикаторная бумажка должна посинеть в щелочной среде) или раствор Mg2+:
MgCl2 + 2NaOH ↔ 2NaCl + Mg(OH)2↓
В проборке с NaOH выпадет белый осадок, в остальных видимых изменений не произойдет.
2) Для определения H2SO4 надо использовать раствор Ва2+:
H2SO4 + BaCl2 ↔ BaSO4↓ + 2HCl.
Выпадает белый осадок, с BaCl2 раствор Ва2+ не взаимодействует.
З) В оставшейся пробирке раствор НСI. Для проверки добавим раствор АgNO3 или Pb(NO3)2.
HCl + AgNO3 ↔ AgCl↓ + HNO3;
2HCl + Pb(NO3)2 ↔ PbCl2↓ + 2HNO3.
Выпадает белый осадок.
Задача 5.
Поваренная соль имеет формулу NaСl. Для определения примеси сульфата можно использовать качественную реакцию с Ва2+:
Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl.
Если выпадает белый осадок, не растворимый в кислотах и щелочах, то поваренная соль содержит примеси сульфатов.
Задача 6.
Для определения сульфата используем характерную реакцию с раствором Ва2+.
Ba2+ + SO42– ↔ BaSO4↓
Выпадает белый осадок. С хлоридом и иодидом реакция не идет.
Для определения хлорида и иодида возьмем раствор АgNO3 (предварительно проверив на сульфат).
Ag+ + Cl– ↔ AgCl↓;
Ag+ + I– ↔ AgI↓.
AgCl белый, AgI — желтый. По цвету можно определить состав выданной соли.
Задача 7.
Растворим полученный оксид меди в серной кислоте при нагревании:
Образуется голубой раствор сульфата меди:
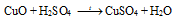
Полученный раствор CuSO4 перельем в фарфоровую чашечку и продолжим греть на огне до появления слабой пленочки на поверхности раствора. Затем снимаем чашечку с огня и оставляем охлаждаться. В растворе образуются кристаллы медного купороса. Теперь их можно осторожно отфильтровать и высушить. Формула медного купороса — CuSO4 . 5Н2О.
Задача 8.
Возьмем раствор соляной кислоты и добавим ее в каждую из пробирок. В пробирке с сульфатом ничего не произойдет. В двух других пробирках выделяется газ. Их можно различить по запаху.
Na2SO3 + 2HCl ↔ 2NaCl + H2O + SO2↑;
Na2S + 2HCl ↔ 2NaCl + H2S↑.
SO2 имеет резкий неприятный запах, H2S имеет характерный запах тухлых яиц.

