Описание электронного строения и геометрической структуры молекулы хлорида бария
Задача 1008.
Описать электронное строение и геометрическую структуру молекулы ВеСI2. В каком состоянии гибридизации находится атом бериллия в молекуле ВеСI2? Как изменится тип гибридизации при переходе ВеСI2 в твердое состояние?
Решение:
Каждый атом хлора, входящий в состав молекулы BeCl2, обладает одним неспаренным электроном:
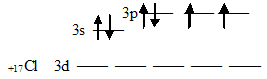
Неспаренный электрон участвует в образовании ковалентной связи с атомом бериллия. Атом бериллия в основном состоянии (1s22s22p0) неспаренных электронов не имеет:
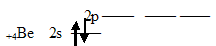
Соответственно, для участия в образовании химических связей по обычному ковалентному механизму атом бериллия должен перейти в возбуждённое состояние (1s22s12p1):
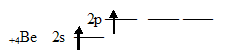
При перекрывании этих двух электронов с неспаренными электронами атомов хлора образуется две - связи Ве — Cl. При этом должны образоваться одна s — p, а другая - p — p связи. Эти связи неравноценны, но фактические измерения показывают, что обе - связи в молекуле BeCl2 одинаковы и молекула имеет линейное строение. Установлено, что центральным атомом в молекуле хлорида бериллия является атом Ве (Cl — Be — Cl). Объяснить это можно тем, что s- и р-орбитали образуют две равноценные гибридные sр-орбитали, которые вытянуты в противоположных направлениях. Два гибридных sр-облака в результате взаимного отталкивания располагаются относительно ядра атома таким образом, угол между ними составляет 1800 (рис. 1. и рис. 2.). В результате такого расположения гибридных орбиталей молекулы BeCl2, где Ве является центральным атомом, имеет линейную конфигурацию, т.е. ядра всех атомов располагаются на одной прямой (рис. 1. и рис. 2.).
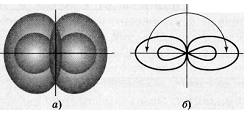
Рис. 1. Взаимное расположение sp-гибридных
орбиталей одного атома
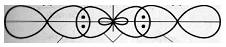
Рис. 2. Трёхатомная молекула BeCl2
При переходе BeCl2 в твёрдое состояние тип гибридизации изменяется. Между отдельными молекулами BeCl2 возникают новые ковалентные связи. В итоге при конденсации BeCl2 образуются линейные полимерные цепи. Объяснить это можно тем, что в общее число электронов в молекуле BeCl2 недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Так в молекуле BeCl2:
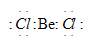
В наружном слое атома бериллия имеются две свободные р-орбитали, а у атома хлора имеются неподелённые электронные пары; поэтому атом Ве способен быть акцептором неподелённых электронных пар, а атом Cl – донором. При охлаждении газообразного хлорида бериллия между отдельными молекулами BeCl2 возникают ковалентные связи по донорно-акцепторному механизму (рис. 3.). При конденсации BeCl2 возникает линейный полимер, в котором атомы хлора играют роль мостиков, связывающих атомы бериллия. (рис. 4.).
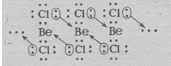
Рис. 3. Ковалентные связи по донорно-акцепторному
механизму между молекулами BeCl2
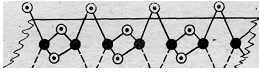
Рис. 4. Схема строения линейного полимера
(BeCl2)n
Тетрагидроксобериллат калия и тетрафторобериллат натрия
Задача 1009.
Написать формулы тетрагидроксобериллата калия и тетрафторобериллата натрия. Как можно получить эти соединения?
Решение:
Для бериллия характерно то, что в водных растворах щелочей он растворяется с образованием гидроксобериллата:
Be + 2KOH + H2O ⇔ K2[Be(OH)4].
тетрагидроксо-
бериллат калия
При взаимодействии BeF2 c фторидами щелочных металлов образуются комплексные соединения фторобериллаты, содержащие ион [BeF4]2-, например:
BeF2 + 2NaF ⇔ Na2[BeF4].
тетрафторо-
бериллат натрия
Здесь атом бериллия находится в состоянии sр-гибридизации, поэтому ион [BeF4]2- построен в форме тетраэдра.

