Степень окисления кремния. Применение кремниевых соединений
Решение задач на составление уравнений окислительно-восстановительных реакций кремниевых соединений
Задание 387
Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
МgSi → SiH4 → SiO2 → K2SiO3 → Н2SiO3
При каком превращении происходит окислительно-восстановительная реакция?
Решение:
Для кремния в своих соединениях характерна степень окисления +4.
Уравнения реакций следующих превращений:
МgSi → SiH4 → SiO2 → K2SiO3 → Н2SiO3
а) МgSi + 2H2SO4 → SiH4 + 2MgSO4
б) Окислительно-восстановительной реакцией является реакция силана с водой
SiH4 + 2Н2О = SiO2 + 4H2↑
Здесь кремний увеличивает свою степень окисления от -4 до +4, т. е. проявляет свойство восстановителя, а водород уменьшает свою степень окисления от +1 до 0, т. е. Проявляет свойство окислителя;
в) SiO2 + K2CO3 → K2SiO3 + CO2↑;
г) K2SiO3 + H2SO4 → Н2SiO3 + K2SO4
Задание 388
Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: SiO2 → Si → K2SiO3 → Н2SiO3
Окислительно-восстановительные реакции напишите на основании электронных уравнений.
Решение:
а) Применение кремниевых соединений
Кремний в больших количествах используется для получения динамной и трансформаторной стали, которые применяются для изготовления трансформаторов, электромоторов и генераторов. В химическом машиностроении применяют кремниевый чугун (15-17% Si), обладающий кислотоупорными свойствами. Ферросилиций служит добавкой в сталь при её выплавке, для удаления из неё кислорода (образуется SiO2, который уходит в шлак).
Особо чистый кремний применяют для изготовления полупроводниковых устройств (интегральные схемы, солнечные батареи и др.). Кварц используется для изготовления кварцевого стекла, выдерживающего нагревание до 1200 0С и пропускающего ультрафиолетовое излучение. Изделие из кварца не растрескивается, даже если его нагреть до красного каления и, затем, опустить в холодную воду, благодаря ничтожно малому коэффициенту термического расширения.
Кристаллический кварц обладает пьезоэлектрическими свойствами. Широко используются кварцевые ультразвуковые вибраторы и эталоны частоты.
Огромное применение имеет стекло. Из него изготавливают стеклянные изделия, оконное стекло, посуду, строительные материалы, стекловолокно, стеклоткань и др. изделия.
Из кремния изготавливают ситаллы – материалы, обладающие химической стойкостью и высокой механической прочностью. Их изготавливают из металлургического шлака.
Цемент, керамика, огнеупоры, кирпичи, фаянс, фарфор, асбоцемент представляют собой материалы, содержащие оксид кремния.
Силикат натрия применяют для огнезащитного покрытия деревянных изделий, в производстве силикатных материалов. Фторокремниевую кислоту используют качестве дезинфицирующего средства.
Муллит – соединение в системе Al2O3 — SiO2, устойчивое при высоких температурах.
Цеолиты используют в качестве селективных адсорбентов при очистке и осушке газов (природный газ) и органических жидкостей (углеводороды).
SiH4 и SiCl4 используют для получения кремнийорганических соединений, из которых получают каучукоgодобные материалы, выдерживающие длительное нагревание до 250 0С и сохраняющие эластичность даже при -60 0С, клей, огнеупорные лаки и эмали, водоотталкивающие вещества для пропитки тканей, силиконовые смазки, протезные пластмассы, электроизоляционные материалы.
б) Уравнения реакций, которые надо провести для осуществления следующих превращений
SiO2 → Si → K2SiO3 → Н2SiO3
1) SiO2 + 2Mg = Si + 2MgO
Уравнения электронного баланса:
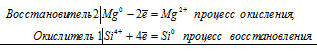
2Mg0 + Si4+ = 2Mg2+ + Si0
Молекулярное уравнение реакции:
SiO2 + 2Mg = Si + 2MgO
В данной реакции магний увеличивает свою степень окисления от 0 до +2, т. е. проявляет свойства восстановителя, а кремний уменьшает свою степень окисления от +4 до 0, т. е. проявляет свойства окислителя.
2). Si + 2KOH + H2O = K2SiO3 + 2H2↑
Уравнения электронного баланса:

Si0 + 4H+ = Si4+ + 2H20
Молекулярное уравнение реакции:
Si + 2KOH + H2O = K2SiO3 + 2H2↑
В данной реакции кремний увеличивает свою степень окисления от 0 до +4, т. е. проявляет свойства восстановителя, а водород уменьшает свою степень окисления от + до 0, т. е. проявляет свойства окислителя.
3) K2SiO3 + H2SO4 = Н2SiO3 + K2SO4
В данной реакции кремний не изменяет свою степень окисления - реакция не является окислительно-восстановительной.

