Составление окислительно-восстановительных реакций соединений серебра, золота и платины
Задание 391.
Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Серная кислота обладает окислительными свойствами (сходными со свойствами азотной кислоты), если её концентрация превосходит 70%. Только тогда можно говорить о специфических свойствах H2SO4, как окислителя. Концентрированная серная кислота, как окислитель восстанавливается активными металлами (от Mg Cr) до H2S, малоактивными металлами (от Fe до Pb) – до свободной серы, а тяжёлыми, инертными металлами (отSb до Au) – до оксида серы (IV). При содержании H2SO4 в растворе менее 70% (разбавленная серная кислота) её поведение описывается в рамках обычных представлений. При взаимодействии разбавленной серной кислоты с металлами, стоящими в электрохимическом ряду напряжений левее водорода, выделяется газообразный водород. С металлами, стоящими в ряду напряжений правее водорода, разбавленная серная кислота не взаимодействует.
В концентрированной серной кислоте элементом-окислителем является атом серы (степень окисления +6), а в разбавленной – водород (степень окисления +1).
Уравнение реакции растворения серебра в концентрированной серной кислоте
Уравнения электронного баланса:
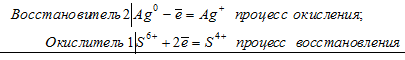
2Аg0 + S6+ = 2Ag+ + S4+
Молекулярное уравнение реакции:
2Аg + 2H2SO4 = Ag2SO4 + SO2 + 2H2O
В данной реакции серебро увеличивает свою степень окисления от 0 до +1, т. е. проявляет свойства восстановителя, а сера уменьшает свою степень окисления от +6 до +4, т.е. проявляет свойства окислителя.
Задание 401
Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнения взаимодействия KI с сульфатом меди.
Решение:
Для меди характерна степень окисления +1 (Cu2O, CuCl, CuI, Cu2S) и +2 [CuO, CuSO4 . 5H2O, Cu(NO3)2 . 6H2O, CuS, Cu2(OH)2CO3]; для серебра: +1 (Ag2O, AgNO3, AgCl, AgBr, AgI); для золота: +3 (AuCl3, H[AuCl4]). Как элементы 2-й группы медь, серебро и золото имеют по одному электрону на внешнем энергетическом уровне (ns1), поэтому должны проявлять степень окисления +1. Характерная степень окисления, как у элементов 2-й группы должна быть +2. Для меди наиболее характерна степень окисления +2, для серебра +1, а для золота +3.
Уравнения взаимодействия KI с сульфатом меди
Уравнения электронного баланса:
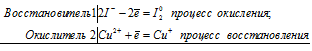
2Сu2+ +2I- = Cu+ + I20
Молекулярное уравнение реакции:
CuSO4 + 2KI = 2CuI↓ + I2 + K2SO4
Задание 404
Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Золото растворяется в «царской водке» с образованием комплекса H[AuCl4]
Уравнения электронного баланса:
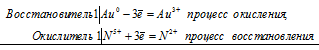
Au0 +N5+ = Au3+ + N2+
Молекулярное уравнение реакции:
3Au + 12HCl + 3HNO3 =
= 3H[AuCl4] + 3NO + 6H2O
б) Золото растворяется в селеновой кислоте с образованием селената золота(III)
Уравнения электронного баланса:
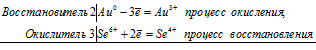
2Au0 + 3Se6+ = 2Au3+ + 3Se4+
Молекулярное уравнение реакции:
2Au + 6H2SeO4 = Au2(SO4)3 + 3SeO2 + 6H2O
Задание 428
Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий - до+8.
Решение:
а) Реакция растворения платины в царской водке
Уравнения электронного баланса:
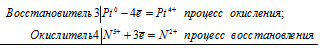
3Pt0 + 4N5+ = 3Pt4+ + 4N2+
Молекулярное уравнение реакции:
3Pt + 4HNO3 + 18HCl =
= 3H2[PtCl6] + 4NO + 8H2O;
б) Реакция взаимодействия осмия с фтором:
Уравнения электронного баланса:
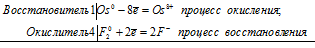
Os0 + 4F20 = Os8+ + 8F–
Молекулярное уравнение реакции:
Os + 4F2 = OsF8.

