Электронное строение атома кремния и химические свойства свободного кремния
Задача 960.
Дать краткую характеристику кремния, указав: а) электронное строение атома и его валентные возможности; б) химические свойства свободного кремния.
Решение:
а) Кремний – элемент с порядковым номером 14, расположен в третьем периоде в главной подгруппе IV-ой группы периодической системе химических элементов Д. И. Менделеева. Атом кремния содержит 14 электронов на трёх энергетических уровнях, на валентном уровне - 4 электрона; заряд ядра равен +14 (14 протонов и 14 нейтронов). Следовательно, электронную формулу кремния можно записать так: 1s22s22p63s23p2. На внешнем валентном уровне атом кремния содержит четыре электрона, из которых два расположены на 3s-подуровне и два неспаренных на 3р-подуровне. Графически строение атома кремния можно представить так:
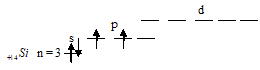
Так как на внешнем электронном слое атом кремния содержит два неспаренных электрона, то его валентность (ковалентность) равна 2 в основном состоянии. При возбуждении атома кремния один из 3s-электронов перейдёт на свободную 3d-орбиталь. Что можно представить электронной формулой 2s22p23d0 или графически:
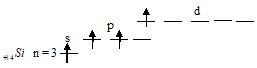
Следовательно, в возбуждённом состоянии атом кремния (или четыре неспаренных электрона) будет проявлять валентность (или ковалентность) равную 4.
б) При обычных условиях свободный кремний химически инертен и реагирует только с фтором с образованием тетрафторида кремния:
Si + 2F2 = SiF4.
От взаимодействия с кислородом даже при нагревании кремний защищает оксидная плёнка:
Si + O2  SiO2
SiO2
При температуре выше 400 0С кремний реагирует также с парами серы, азотом, фосфором, углеродом и бором:
Si + C = SiC;
Si + 2S = SiS2;
Si + 4B = B4Si.
С металлами кремний образует силициды:
Si + 4Li = Li4Si.
С водородом и кислотами кремний не реагирует. Исключение составляет смесь азотной и фтороводородной кислот; кремний растворяется в щелочах:
Si + 2NaOH + H2O = Na2SiO3 + H2↑.
Задача 961.
Охарактеризовать физические и химические свойства диоксида кремния, его отношение к воде, кислотам и щелочам.
Решение:
Диоксид кремния SiO2 – бесцветное соединение, которое может существовать в кристаллической, аморфной и стеклообразной форме. В кристаллической форме SiO2 образует несколько модификаций, различающиеся особенностями взаимного расположения структурных единиц – кремнекислородных тетраэдров состава SiO4:
Взаимные превращения кристаллических модификаций диоксида кремния сопровождается изменением объёма и плотности. Модификации SiO2: α - кварц (горный хрусталь) – бесцветное кристаллическое вещество с сильным двойным лучепреломлением, очень твёрдое и тугоплавкое вещество. Кристаллический кварц химически очень инертен. При обычных условиях он взаимодействует только с F2 и с водным раствором плавиковой кислоты:
SiO2 + 4HF = SiF4 + 2H2O.
С водой SiO2(к) не взаимодействует, но аморфный при обычных условиях, а микрокристаллический – при температуре выше 150 0С и высоком давлении – очень медленно растворяется в воде с образованием ортокремниевой кислоты:
SiO2 + 2Н2О H4SiO4.
H4SiO4.
В растворах щелочей растворение SiO2 происходит гораздо быстрее, чем в воде, и тем быстрее, чем выше концентрация гидроксид-иона ОН– и выше температура:
SiO2 + 2NaOH = Na2SiO3 + H2O.
Обычно же кремнекислые соли получают сплавлением диоксида кремния со щелочами или карбонатами:
SiO2 + Na2CO3  Na2SiO3 + CO2↑.
Na2SiO3 + CO2↑.
При прокаливании SiO2 с углем в электрической печи до 2000 0С образуется карбид кремния (карборунд):
SiO2 + 3С  SiC + 2CO↑.
SiC + 2CO↑.

