"Химия. 11 класс". О.С. Габриелян (гдз)
Гибридизация атомов. Образование гибридных орбиталей
Вопрос 1.
На изменение величины угла связей в этих молекулах оказывают влияние отталкивающие свойства неподеленных электронных пар, занимающих sp3-гибридные орбитали, а у атомов азота одна электронная пара, а у кислорода две.
Вопрос 2.
В кристалле алмаза в атомах углерода все электроны задействованы в образовании связей друг с другом, поэтому он не проводит электрический ток, т.к. нет частиц, которые переносили бы заряд. В молекуле графита в атомах углерода в образовании гибридных орбиталей участвуют 3 электрона, а один электрон остается негибридизированным, за счёт него графит и проводит электрический ток.
Вопрос 3.
Молекула фторида бора имеет форму правильного треугольника, т.к. атом бора находится в состоянии sp2-гиридизации.
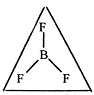
Молекула фторида азота будет иметь форму тригональной пирамиды, т.к. атом азота находится в состоянии sp3-гибрбдизации, но имеет одну неподелённую электронную пару.
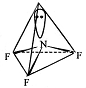
Вопрос 4.
Молекула SiF4 имеет тетраэдрическую форму, т.к. атом кремния находится в состоянии sp3-гибридизации, а атом бора в молекуле BCl3 находится в состоянии sp2-гибридизации, поэтому молекула имеет форму плоского треугольника.

