Элементы подгруппы галлия
Задача 1058.
Какие степени окисленности характерные для элементов подгруппы галлия? В какой степени окисленности более устойчивы соединения галлия и индия, и в какой - соединения таллия?
Решение:
Электронные формулы валентных подуровней элементов подгруппы галлия одинаковы (ns2np1). Эти элементы содержат по одному неспаренному электрону на р-подуровне, поэтому могут проявлять в основном состоянии ковалентность равную 1. В возбуждённом состоянии атомы элементов подгруппы галлия на внешнем слое имеют три неспаренных электрона (ns1np2), поэтому могут проявлять ковалентность равную 3. Исходя из этого галлий, индий и таллий в своих соединениях могут проявлять степень окисления +1 и +3. Для соединений галлия и индия характерна степень окисления +3, а для таллия - в большинстве случаев +3.
Димеризация галогенидов алюминия
Задача 1059.
Чем объяснить склонность молекул галогенидов алюминия к димеризации?
Решение:
У алюминия появляется d-подуровень во внешнем электронном слое его атома. Благодаря этому координационное число алюминия в его соединениях может равняться не только четырем, как у бора, но и шести. Соединенная алюминия типа AlЭ3, как и аналогичные соединения бора, электронодефицитны в отдельных молекулах подобных соединений во внешнем электронном слое атома алюминия находится только шесть электронов. Поэтому здесь атом алюминия способен быть акцептором электронных пар. В частности, для галогенидов алюминия характерно образование димеров, осуществляемое по донорно-акцепторному способу (на схеме Г — атом галогена):
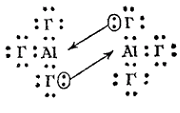
Рис. 1. Схема электронного строения димера Al2Г6
Как видно, подобные димерные молекулы содержат по два «мостиковых» атома галогена. Пространственная структура этих молекул отвечает двум тетраэдрам с общим ребром. Каждый атом алюминия связан с четырьмя атомами галогена, а каждый из центральных атомов галогена - с обоими атомами алюминия. Из двух связей центрального атома галогена одна является донорно-акцепторной, причем алюминий функционирует в качестве акцептора (Рис. 1).
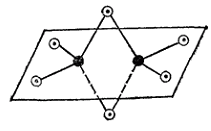
Рис. 2. Схема пространственного строения молекулы Al2Cl6:
черные кружки — атомы алюминия, светлые — атомы хлора.
Галогениды алюминия существуют в виде димерных молекул Al2Г6 в расплавах и в парах. Плотности паров AlCl3, AlBr3 и AlI3 при сравнительно невысоких температурах более или менее точно соответствуют удвоенным формулам -Al2Г6. Однако по традиции их состав обычно выражают в форме AlГ3.
Вычисление растворимости вещества
Задача 1060.
Вычислить растворимость Tl2CrO4, если значение ПР этой соли при 20°С равно 9,8 . 10-13.
Решение:
Tl2CrO4 ⇔ 2Tl+ + CrO42-
ПР(Tl2CrO4) = [Tl+]2 . [CrO42-] = (2х2 . х) = 4х3 = 9,8 . 10-13.
Растворимость Tl2CrO4 в чистой воде равна:
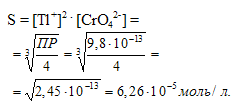
Ответ: 6,26 . 10-5 мль/л.

