Как правильно рассчитать массу вещества по уравнению реакции
Задача 1055.
Сравнить массы гидрида кальция и металлического алюминия, необходимые для получения 50 л водорода.
Решение:
а) Уравнение реакции имеет вид:
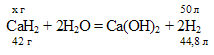
Находим массу СаН2 из пропорции:
42 : 44,8 = х : 50;
х = (50 . 42)/44,8 = 46,875 г.
б) Уравнение реакции имеет вид:
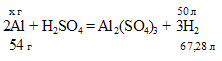
Находим массу Al из пропорции:
54 : 67,2 = х : 50;
х = (50 . 54)/67,28 = 40,18 г.
Ответ: 46,875 г СаН2; 40,18 г Al.
Алюмоаммониевые квасцы
Задача 1056.
Как из алюмоаммониевых квасцов получить: а) гидроксид алюминия; б) сульфат бария; в) алюминат калия? Написать уравнения соответствующих реакций.
Решение:
а) При действии на алюмоаммониевые квасцы водой происходит гидролиз и образуется гидроксид алюминия:
NH4Al(SO4)2 + 3H2O =
= Al(OH)3↓ + NH3↑ + 2H2SO4.
б) При действии на алюмокалиевые квасцы раствором хлорида бария образуется осадок сульфата бария:
NH4Al(SO4)2 + 2ВаCl2 =
= 2BaSO4↓ + NHCl + AlCl3.
в) При действии на алюмоаммониевые квасцы раствором гидроксидом калия образуются комплексные диакватетрагидроксоалюминат(III)-ионы:
NH4Al(SO4)2 + КОН + 5H2O =
= K[Al(OH)4(H2O)2] + NH3↑ + 2H2SO4/
Уравнения реакций
Задача 1057.
Закончить уравнения реакций:
а) B + HNO3 (конц.) →
б) Na2B4O7 + H2SO4 + H2O →
в) H3BO3 + NaOH →
г) Al2(SO4)3 + Na2S + H2O →
д) Al + NaOH + H2O →
е) AlCl3 + Na2CO3 + H2O →
Решение:
а) B + 3HNO3 (конц.) → H3BO3 + 3NO2↑;
б) Na2B4O7 + H2SO4 + 5H2O →
→ Na2SO4 + 4H3BO3;
в) 4H3BO3 + 2NaOH → Na2B4O7 + 7H2O;
г) Al2(SO4)3 + 3Na2S + 6H2O →
→ 2Al(OH)3↓ + 3H2S↑ + 3Na2SO4;
д) 2Al + 2NaOH + 6H2O →
→ 2Na[Ai(OH)4] + 3H2↑;
е) 2AlCl3 + 3Na2CO3 + 3H2O →
→ 2Al(OH)3↓ + 6NaCl + 3CO2↑.

