Как протекают различные химические процессы
Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
AlCl3 + 3NH3 = Al(OH)3↓+ 3NH4Cl.
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2]−:
AlCl3 + 4NaOH + 2H2O =
= Na[Al(OH)4(H2O)2] + 3NaCl.
Тетрагидроксодиаква –
- алюминат(III) натрия
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции: 4Аl + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
4Al + 3CO2 = 2Al2O3 + 3C.
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG0(СО2) = -394,6 кДж/моль; ΔG0(Al2O3) = -1583,3 кДж/моль.
Находим энергию Гиббса реакции:
ΔG0 = 2ΔG0(Al2O3) - 3ΔG0(СО2) =
= 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Так как ΔG0 < 0, то возможно самопроизвольное протекание процесса.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: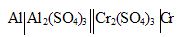 восстановилось до свободного металла 31,2 г хрома. Определить, насколько уменьшилась масса алюминиевого электрода.
восстановилось до свободного металла 31,2 г хрома. Определить, насколько уменьшилась масса алюминиевого электрода.
Решение:
MЭ(Al3+) = M(Al3+)/3 = 26, 981/3 = 8,999 г/моль;
MЭ(Cr3+) = M(Cr3+)/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
?(Сr3+) = ?(Al3+).
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr3+)/MЭ(Cr3+) . MЭ(Al3+) =
= 31,2/17,332 . 8,999 = 16,198 г.
Ответ: 16,198 г.

