Как рассчитать количество теплоты реакции и энергию Гиббса
Расчет количества теплоты реакции
Задача 1015.
Пользуясь табличными данными, рассчитать, сколько теплоты выделяется при гашении 1 кг извести.
Решение:
Уравнение реакции:
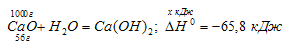
ΔН0(Н2О) = -186,0 кДж/моль;
ΔН0(СаО) = -635,0 кДж/моль;
ΔН0(Са(ОН)2 = -986,8 кДж/моль.
Рассчитаем ΔН0х.р. реакции:
ΔН0х.р. = ΔН0(Са(ОН)2 – ΔН0(СаО) + ΔН0(Н2О)] =
= -986,8 – [-635,0 + (-286,0)] = -65,8 кДж.
Теперь рассчитаем, сколько теплоты (Q) выделится при гашении 1 кг извести:
56 : 65,8 = 1000 : х;
х = (1000 . 65,8)/56 = 1175 кДж.
Ответ: Q = 1175 кДж.
Расчет энергии Гиббса реакции
Задача 1016.
Протекание какой из двух реакций возможно:
а) N2O + 3Mg = Mg3N3 + 1/2O2;
б) N2O + Mg = MgO + N2.
более вероятно при взаимодействии магния с N2O? Ответ обосновать расчетом.
Решение:
ΔG0(N2O) = 104,2 кДж/моль;
ΔG0(MgO) = -569,6 кДж/моль;
ΔG0(Mg3N2) = -401кДж/моль.
Уравнения реакции имеют вид:
а) N2O + 3Mg = Mg3N3 + 1/2O2;
б) N2O + Mg = MgO + N2.
Рассчитаем энергию Гиббса для обеих реакций:
ΔG0(а) = ΔG0(Mg3N2) - ΔG0(N2O) =
= -401 – 104,2 = -505,2 кДж;
ΔG0(б) = ДΔG0(MgO) - ΔG0(N2O) =
= -569,6 – 104,2 = -673,8 кДж.
Так как -673,8 < -505,2 [ΔG0(б) < ΔG0(а)], то реакция (б) более вероятна, чем реакция (а); потому что энергия Гиббса реакции (б) меньше, чем реакции (а).

