Процессы получения водяного пара и генераторного газа
Задача 957.
Исходя из ΔН° образования СО2, СО и водяного пара, доказать, что процесс получения генераторного газа экзотермичен, а процесс получения водяного газа эндотермичен.
Решение:
ΔН°(СО) = -110,6 кДж/моль;
ΔН°(Н2О) = - 241,98 кДж/моль.
а) Генераторный газ получают путём сжигания угля в специальных газогенераторных печах по реакции:
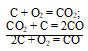
или
С + 1/2O2 = CO.
Находим ΔН°а), используя следствие из закона Гесса:
ΔН°а) = ΔН° (СО) = -110,6 кДж.
Так как ΔН°а) < 0, то процесс получения генераторного газа экзотермичен.
б) При получении водяного газа протекает реакция:
С(к) + Н2О(г) = СО(г) + Н2(г)
Находим ΔН°б):
ΔН°б) =ΔН° (СО) - ΔН° (Н2О) = -110,6 – (-241,98) = 131,38 кДж.
Так как ΔН°б) > 0, то процесс получения водяного газа эндотермичен.
При расчетах ΔН° учитывали, что энтальпии образования простых веществ условно приняты равными нулю.
Задача 958.
Карбид кальция получают по схеме: СаО + С → СаС2 + СО. Вычислить массу СаО, необходимую для получения 6,4 т СаС2. Какой объем СО при этом образуется (условия нормальные)?
Решение:
М(СаО) = 56 г/моль;
M(CaC2) = 64 г/моль;
Vm = 22.4 л/моль .
Уравнение реакции имеет вид:
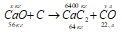
Рассчитаем массу СаО, необходимую для получения 6,4 т СаС2 из пропорции:
56 : 64 = х : 6400;
х = (6400 . 56)/64 = 5600 кг.
Теперь рассчитаем объём СО:
64 : 22,4 = 6400 : у;
у = (6400 . 22,4)/64 = 2240 м3.
Ответ: 5,6 т; 2240 м3.
Задача 959.
Указать состав и свойства синильной кислоты. Почему соли этой кислоты необходимо хранить в плотно закрытых сосудах? Ответ пояснить уравнениями реакций.
Решение:
Циановодород НСN – бесцветная жидкость. В водных растворах проявляет свойства слабой кислоты:
НСN↔ Н+ + СN–
Нейтрализацией синильной кислоты основанием образуется хорошо растворимые в воде соли синильной кислоты – цианиды:
НСN +КОН ↔ КСN + Н2О
Цианиды щелочных и щелочно-земельных металлов диссоциируют в водных растворах с отщеплением цианид-ионов СN–. Цианиды – сильнейшие яды, токсичность которых основана на очень быстром ингибировании цитохромоксидазы (фермент, переносящий электроны на О2) и прекращении клеточного дыхания. Цианиды щелочных и щелочно-земельных металлов гидролизуются в водных растворах по аниону СN– с образованием слабого электролита – НСN (СN– + Н2О ↔ НСN + ОН–, который, обладая высокой летучестью, может попадать в дыхательные пути и вызывать отравление организма. Поэтому кристаллы и растворы цианидов необходимо хранить в плотно закрытых сосудах.

