Характерные реакции димеризации, внутримолекулярного окисления-восстановления
Задача 936.
Какие из перечисленных соединений способны к реакции димеризации: a) NО2 ; б) NOCl; в) N2H4; г) N2О? Потому что: 1) степень окисленности азота в этом соединении не максимальная; 2) азот имеет неподеленную пару электронов; 3) молекула парамагнитна.
Решение:
a) NО2.
Электронное строение молекулы NО2 рассматривается как резонансный гибрид двух форм с изогнутой структурой:
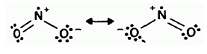
При димеризации NО2 неспаренные электроны каждой их двух молекул обобществляются, образуя слабую связь N — N. Образующийся димер N2O4 по своему электронному строению может рассматриваться как резонансный гибрид двух форм с плоской структурой:
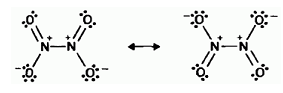
б) NOCl.
В молекуле NOCl все три валентных неспаренных р-электрона атома азота образуют связь с атомом кислорода (две ковалентные связи) и одну связь с атомом хлора. Таким образом, в молекуле NOCl нет неспаренных электронов и поэтому она не способна к димеризации.
в) N2H4.
Структурная формула гидразина:
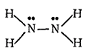
В молекуле гидразина атомы азота имеют неподеленные пары электронов. Нет неспаренных электронов, поэтому гидразин не димеризуется.
г) N2О.
На МО молекулы N2O должны разместиться 16 электрона: по пять азота – 2s22p3 (10 от двух атомов) и шесть кислорода – 2s22p4. 10 валентных р-электронов и 6 валентных s-,электронов, участвующих в образовании N2O попарно будут находиться на не связывающих и связывающих МО, значит она диамагнитна. Так как в N2O нет неспаренных электронов, то он не способен к димеризации.
Ответ: а3
Задача 937.
Для каких из перечисленных веществ характерны реакции внутримолекулярного окисления-восстановления: a) KNО2; б) KNO3; в) (NH4)2Cr2О7 ; г) (NH4)3PО4? Потому что: 1) в данном веществе азот проявляет окислительно-восстановительную двойственность; 2) при разложении выделяются газообразные продукты; 3) в молекуле кроме атома азота-окислителя присутствует атом-восстановитель; 4) в молекуле кроме атома азота-восстановителя присутствует атом-окислитель.
Решение:
К реакциям внутримолекулярного окисления-восстановления относятся процессы, при которых происходит изменение степени окисления разных элементов в одном и том же веществе, т.е. в которых окислитель и восстановитель находятся в составе одной и той же молекулы
a) KNО2.
Выше точки плавления при температуре 440-442 0С нитрит калия разлагается по реакции:
4 KNО2 → 2K2O + 2N2↑ + 3O2↑.
При этом степень окисления азота изменяется от +3 до 0, степень окисления кислорода от -2 до 0. В данном процессе в молекуле KNО2 азот – окислитель, а кислород - восстановитель, значит, для нитрита калия характерна реакция внутримолекулярного окисления-восстановления.
б) KNO3.
Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2:
2KNO3  2KNO2 + O2↑.
2KNO2 + O2↑.
При этом степень окисления азота изменяется от +5 до +3, степень окисления кислорода от -2 до 0. В данном процессе в молекуле KNО3 азот – окислитель, а кислород - восстановитель, значит, для нитрата калия характерна реакция внутримолекулярного окисления-восстановления.
в) (NH4)2CrО7.
При нагревании (NH4)2CrО7 бурно разлагается с выделением газообразного азота:
(NH4)2CrО7  N2 + Cr2O3 + 4 H2O.
N2 + Cr2O3 + 4 H2O.
При этом степень окисления хрома изменяется от +6 до +3, степень окисления азота от -3 до 0. В данном процессе в молекуле (NH4)2CrО7 азот – восстановитель, а хром - окислитель, значит, для нитрата калия характерна реакция внутримолекулярного окисления-восстановления.
г) (NH4)3PО4
Ортофосфат аммония разлагается с выделением NH3:
При этом изменение степеней окисления атомов не наблюдается.
(NH4)3PО4  Н3PO4 + 3NH3↑
Н3PO4 + 3NH3↑
Реакция протекает без изменения степеней окисления атомов элементов, значит, реакция не является окислительно-восстановительной.
Ответ: а3, б3; в4.
Задача 938.
Какова реакция среды в растворе хлорида гидроксиламиния: а) кислая; б) нейтральная; в) щелочная? Потому что: 1) в состав молекулы входит группа — ОН; 2) протекает реакция гидролиза соли; 3) азот в этом соединении четырехковалентен и не присоединяет ион водорода.
Решение:
Хлорид гидроксиламиния — неорганическое соединение, соль гидроксиламина NH2OH и соляной кислоты HCl с формулой (NH3OH)Cl. Так как хлорид гидроксиламиния соль слабого основания NH2OH и сильной кислоты HCl, то гидролиз протекает по катиону:
(NH3OH)Cl ↔ (NH3OH)+ + Cl–;
(NH3OH)+ + H2O ↔ (NH3OH)OH + H+.
В растворе соли хлорида гидроксиламиния протекает гидролиз, при котором образуется избыток ионов Н+, значит, реакция среды кислая (рН < 7).
Ответ: а2.
Задача 939.
С какими из перечисленных веществ реагирует концентрированная азотная кислота: а) Р2О5 ; б) НС1; в) С12; г) I2; д) СаО; е) Сu; ж) А1; з) СO2 ; и) HPO3? При этом азотная кислота проявляет: 1) кислотные свойства; 2) окислительные свойства; 3) не проявляет ни тех, ни других свойств.
Решение:
Уравнения реакций взаимодействия концентрированной азотной кислоты:
а) Р2О5 + 2HNO3(конц) → 2HPO3 + N2O5;
б) НС1 + HNO3(конц) 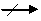
Ракция не идёт, так как концентрированная азотная кислота с соляной кислотой не реагирует.
в) 4С12 + 2HNO3(конц) →
→ 2HCl + 2NCl2 + 3O2↑;
г) 4I2 + 2HNO3(конц) →
→ 2HI + 2NI2 + 3O2↑;
д) СаО + 2HNO3(конц) →
→ Ca(NO3)2 + H2O.
Проябляет кислотные свойства, вступает в реакцию с основными оксидами.
е) Сu + 4HNO3(конц) → Cu(NO3)2 + 2NO2↑+ 2H2O
Азотная кислота проявляет свойства окислителя.
ж) А1 + HNO3(конц) 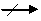
Концентрированная азотная кислота с алюминием не взаимодействует, так как пассивирует металл.
з) СO2 + HNO3(конц) 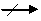
Азотная кислота с кислотныи оксидами не взаимодействует.
и) HPO3 + HNO3(конц) 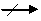
Азотная кислота с кислотами не взаимодействует.

