Характеристика химических свойств гидроксиламина
Гидроксиламин
Задача 895.
Охарактеризовать окислительно-восстановительные свойства гидроксиламина и его солей, привести примеры соответствующих реакций.
Решение:
Формула гидроксиламина NH2OH. Структурная формула имеет вид:
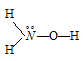
Гидроксиламин – слабое основание:
NH2OH + H2O ↔
↔ NH3OH+ + OH– (K = 1,1 . 10-6).
Степень окисления азота в молекуле гидроксиламина равна -1, поэтому он и его соли проявляют как окислительные свойства, так и восстановительные:
N-1H2OH + FeCl2 + 3HCl ↔
↔ N-3H4Cl + 2FeCl3 + H2O.
Здесь NH2OH проявляет свойства окислителя, уменьшает степень окисления от -1 до -3.
2N-1H2OH + HOCl ↔ N20 + HCl + 3H2O.
Здесь NH2OH проявляет свойства восстановителя, увеличивает степень окисления от -1 до 0.
Однако для гидроксиламина наиболее характерны восстановительные свойства.
Способы получения оксидов азота
Задача 896.
Указать способы получения оксидов азота. Почему прямым синтезом из N2 и О2 может быть получен только оксид азота (II)? Почему заметный выход NО при взаимодействии N2 и О2 наблюдается лишь при высоких температурах?
Решение:
Все оксиды азота могут быть получены из азотной кислоты или её солей.
a) Оксид азота (I) N2О получается при нагревании нитрата аммония:
NH4NO3  N2O↑ + 2H2O.
N2O↑ + 2H2O.
б) В лаборатории оксид азота (II) NО получается при взаимодействии 25-35%-ой азотной кислоты с медью:
3Cu + 8HNO3 =
= 3Cu(NO3)2 + 2NO↑ + 4H2O.
В промышленности он является промежуточным продуктом при производстве азотной кислоты (при высокой температуре и давлении при участии Pt, Cr2O3):
4NH3 + 5O2 = 4NO↑ + 6H2O.
Чистый, не загрязнённый примесями NO можно получить по реакциям:
FeCl2 + NaNO2 + 2HCl →
→ FeCl3 + NaCl + NO + H2O;
2HNO2 + 2HI → 2NO + I2 + H2O.
в) Получение N2O3.
Оксид азота (III) N2O3 можно получить при пониженных температурах смешиванием равных объёмов NO2 и NO:
NO2 + NO ↔ N2O3.
При взаимодействии 50 %-ной азотной кислоты с оксидом мышьяка (III) при низкой температуре:
2HNO3 + As2O3 + 2H2O =
= 2H2AsO4 + N2O3.
При обезвоживании азотистой кислоты:
NaNO2 + H2SO4 = NaHSO4 + HNO2;
2HNO2 = N2O3 + H2O.
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:
N2+O2 ⇒ 2NO;
2NО + O2 ⇒ 2NO2;
NO2 + NO ⇒ N2O3
г) Оксид азота (IV) NO2 получают окислением NO как промежуточный продукт при производстве азотной кислоты:
2NO + O2 = 2NO2
г) Оксид азота (IV) NO2 получают окислением NO как промежуточный продукт при производстве азотной кислоты:
2NO + O2 = 2NO2
д) Оксид азота (V) N2O5 обезвоживанием азотной кислоты оксидом фосфора (V) или из NO2 окислением озоном:
4HNO3 + P4O10 ↔ 2N2O5 + H4P4O12
Тетраметафосфорная
кислота
Путём взаимодействия оксида азота(IV) с озоном:
2NO2 + Oз ↔ N2O5 + O2
При пропускании сухого хлора над сухим нитратом серебра:
4AgNO3 + 2l2 → 4AgCl↓ + N2O5 + O2↑
В случае реакции (прямое взаимодействие азота и кислорода):
N2 + O2 ↔ 2NO; ΔН = -180,8 кДж.
Поскольку в ходе этой реакции число частиц не изменяется, то протекание реакции до конца, как в прямом, так и в обратном направлении не увеличивает состояния системы. Не изменяется при этом и число возможных состояний атомов: в исходных веществах каждый атом связан с атомом другого элемента. Иначе обстоит дело при частичном протекании реакции в прямом или обратном направлении. При сосуществовании исходных веществ и продуктов реакции, атомы азота и кислорода связаны в молекулы N2 и O2, а часть – в молекулы NO. Таким образом, число возможных микросостояний рассматриваемой системы, следовательно, и вероятность соответствующего её макросостояния возрастает при частичном протекании реакции.
Тенденция к переходу в состояние с наименьшей внутренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Итак с повышением температуры реакция протекает в направлении эндотермитческого процесса, поэтому все возможные реакции азота с кислородом протекают в обратном направлении, т. е.. реакции образования оксидов азота практически не протекают. И только система N2+ O2 ↔ 2NO при достаточно высокой температуре будет стремиться к смещению равновесия вправо, как система, стремящаяся к увеличению вероятности состояния. Распад NO в данной системе проходит не до конца, устанавливается равновесие. Благодаря этому NО можно получить из простых веществ при температурах электрической дуги (3000- 4000 0С).
Итак, тенденция к переходу в состояние с наименьшей внутренней энергией проявляется при всех температурах в одинаковой степени, а тенденция же к достижению наиболее вероятного состояния (N2+O2 ↔ 2NO) проявляется тем сильнее, чем выше температура. Все остальные системы азот — кислород — оксид азота протекают с уменьшением состояния вероятности, поэтому реакции не протекают.
Электронное строение NO (Метод молекулярных орбиталей)
Задача 897.
Описать электронное строение молекулы NО по методу MО.
Решение:
В образовании молекулы NO участвует одиннадцать электронов, пять от атома азота и шесть от атома кислорода:
N[2s22p3] + O[2s22p4] →
→ [NOσ2s)2(σ*2s)2(σх2р)2(πу2р)2(πz2р)2(πy*2р)1(πz*2р)0( σx*2p)0
С позиций метода МО электронное строение молекулы NO можно представить так:
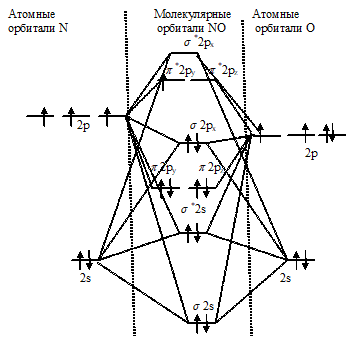
Здесь на МО переходят четыре 2р-электрона атома кислорода и три 2р-электрона атома азота. Энергия 2р-электронов соединяющихся атомов неодинакова: заряд ядра атома кислорода выше, чем заряд ядра атома азота, так что 2р-электронгы в атоме кислорода сильнее притягиваются ядром. Поэтому на диаграмме расположение 2р-орбиталей атома кислорода соответствует более низкой энергии в сравнении с 2р-орбиталями атома азота. Как показывает схема, из семи электронов, участвующих в образовании связи, шесть размещаются на трёх связывающихся орбиталях и один – на разрыхляющейся орбитали (π*y). Порядок связи равен:
ω = (6 - 1)/2 = 2,5
Порядок связи 2,5 указывает на то, что связь молекуле прочнее, чем обычная двойная связь. Этим и объясняется, что при обычных условиях термодинамически неустойчивая молекула NO не распадается. Лишь при температуре выше 1000 0С молекула NO диссоциирует. Наличие неспаренного электрона объясняет парамагнитные свойства молекулы NO. Парамагнитные свойства и термическую прочность NO с позиций метода ВС объяснить невозможно.

