Строение и свойства оксидов азота
Задача 898.
Описать химические свойства N2О и NO. К какому классу оксидов относятся эти соединения?
Решение:
а) Химические свойства N2O:
1) При нагревании выше 500 0С оксид азота (I) разлагается на азот и кислород:
2N2O ↔ 2N2 + O2
2) Оксид азота (I) – сильный окислитель. Реакции N2O с аммиаком и водородом могут сопровождаться взрывом:
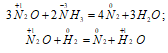
В водном растворе N2O взаимодействует с катионом Sn2+, восстанавливаясь до NH2OH, а раствор SO2 в воде восстанавливает N2O до N2:
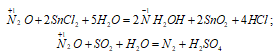
б) Химические свойства NO. В NO атом азота находится в своей промежуточной степени окисления +2, поэтому для него характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей – восстанавливается.
1) NO как восстановитель:
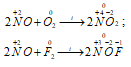
2) NO как окислитель:
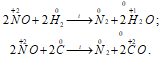
3) При взаимодействии NO с щелочными металлами образуется нитроксил-ион NO–, который является электронным аналогом молекулы О2 и имеет кратность связи 2:
NO + Na ↔ Na+ + NO–
Нитроксил-ион играет роль промежуточного соединения в обратимых процессах нитрификации. Он димеризуется с образованием гипонитрит-иона:
2NO– ↔ N2O22-
4) Молекула NO относительно легко теряет электрон, превращаясь в прочный катион нитрозила NO+, изоэлектронный молекулам N2 и СО. Этот катион образует соли нитрозила:
NOF + BF3 ↔ [BF4]–
Тетрафторо-
борат (III) нитрозила
В водных растворах соли нитрозила гидролизуются:
NO+ + Н2О ↔ HNO2 + H+
Монооксид азота может быть лигандом в комплексных соединениях. Как лиганд NO называют «нитрозил». Например, [Fe(NO)4] – тетранитрозилжелезо, [Fe(H2O)5NO]Cl2 – хлорид нитрозилпентаакважелеза(II), K2[Fe(NO)(CN)5] – пентацианонитрозилферрат(III).
Оксиды N2O и NO – не солеобразующие сосуды. Они не взаимодействуют с водой, растворами кислот и оснований.
Задача 899.
Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы? Из каких молекул он состоит? Почему его окраска усиливается при повышении температуры и ослабляется при ее понижении? Будет ли этот газ подчиняться закону Бойля — Мариотта, если подвергать его сжатию при постоянной температуре? Составить уравнения реакций, происходящих при растворении этого газа в воде и в растворе щелочи.
Решение:
При действии на металлы концентрированной азотной кислотой выделяется оксид азота (IV) NO2 – бурый и очень токсичный газ:
Сu + HNO3(конц.) ↔ Сu(NO3)2 + NO2↑ + H2O
Молекула NO2 нелинейная:
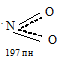
Угол ONO равен 134,1 0
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
2ОN. + .NO2 ↔ 2ОN—NO2
При температуре от -11,2 0С до 140 0С бурый газ состоит из молекул NO2 и N2O4, которые в интервале этих температур находятся в равновесии друг с другом:
N2O4 ↔ 2NO2; ΔН = -56,9 кДж.
При повышении температуры до 140 0С окраска бурого газа усиливается до почти чёрной. Это объясняется тем, что при нагревании равновесие в системе
N2O4 —2NO2 сместится в сторону образования NO2, т. е. при нагревании идёт диссоциация молекул N2O4 до образования в системе преимущественно молекул NO2, которые и придают тёмно-бурую окраску. Наоборот, при охлаждении в системе N2O4 —2NO2 происходит преимущественно димеризация молекул NO2 с образованием молекул N2O4, что и приводит к ослаблению окраски бурого газа.
Если мы будем повышать температуру системы больше 140 оС, то начнётся диссоциация молекул NO2 на NO и О2 (2NO2 ↔ 2NO + О2) и газ будет обесцвечиваться.
Если же бурый газ подвергнуть сжатию при постоянной температуре, то равновесие в системе N2O4 ↔ 2NO2, согласно принципу Ле Шателье, сместится влево, в сторону уменьшения числа газообразных веществ (в сторону уменьшения объёма в системе). При этом объём системы уменьшится, окраска будет становиться светлее.
Задача 900.
Почему молекула NO2 легко димеризуется, а для SO2 подобный процесс не характерен?
Решение:
Молекула NO2 нелинейная, имеет угловую форму с sp2-гибридизацией орбиталей атома азота:
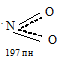
Угол ONO равен 134,10
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
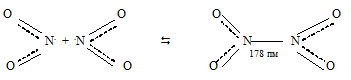
угол ONO = 1350
или
2ОN. + .NO2 ↔ 2ОN—NO2
Молекула N2O4 плоская. Таким образом, связь между двумя молекулами NO2 происходит за счёт объединения неспаренных электронов атомов азота обеих молекул.
Молекула SO2 имеет также как молекула NO2 угловую форму с sp2-гибридизацией орбиталей атома серы:
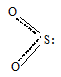
Угол OSO равна 119,50, длина связи O—S равна 143 пм.
На связывающей орбитали в молекуле SO2 находятся два спаренных электрона, поэтому молекулы не могут димеризоваться.

