"Химия. 11 класс". Интерактивные тесты (ЕГЭ)
Часть 1. Вариант 2
(Могут быть использованы как тренировочные тесты для подготовки к ЕГЭ
При выполнении заданий данной части выберите правильный ответ, щелкнув мышью на кнопке с его номером.
Тест 1
Вопрос. Восьмиэлектронyую внешнюю оболочку имеет ион
Тест 2
Вопрос. Какую электронную конфигурацию имеет атом наиболее активного металла?
Тест 3
Вопрос. Вещества только с ионной связью приведены в ряду:
Тест 4
Вопрос. Наибольшую степень окисления марганец имеет в соединении
Тест 5
Вопрос. Кристаллическая решётка графита
Тест 6
Вопрос. Только кислотные оксиды расположены в ряду:
Тест 7
Вопрос. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
Тест 8
Вопрос. Оксиды с общей формулой R2O3 и R2O5 образуют элементы подгруппы
Тест 9
Вопрос. Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует как с активными, так и с неактивными металлами.
Б. Хлор не растворяется в воде
Тест 10
Вопрос. Между собой взаимодействуют
Тест 11
Вопрос. Гидроксид цинка реагирует с каждым из веществ
Тест 12
Вопрос. С каждым из перечисленных веществ:
H2S, KOH, Zn
взаимодействует
Тест 13
Вопрос. В схеме превращений:
FeCl3 → X1 → X2 → Fe(OH)3
веществами « X1» и «X2» могут быть соответственно
Тест 14
Вопрос. Изомерами являются
Тест 15
Вопрос. В молекуле бутана каждый атом углерода находится в состоянии гибридизации
Тест 16
Вопрос. Атом кислорода в молекуле фенола образует
Тест 17
Вопрос. При взаимодействии муравьиной кислоты с магнием образуются
Тест 18
Вопрос. Веществами «X» и «Y» в схеме превращений
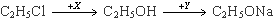
являются
Тест 19
Вопрос. Какому типу реакции соответствует уравнение:
Zn + H2SO4 = ZnSO4 + H2,
Тест 20
Вопрос. Скорость химической реакции между медью и азотной кислотой зависит от
Тест 21
Вопрос. При повышении давления равновесие смещается вправо в системе
Тест 22
Вопрос. Ионы I– образуются при диссоциации
Тест 23
Вопрос. Нерастворимая соль образуется при взаимодействии
Тест 24
Вопрос. Процесс окисления отражён схемой
Тест 25
Вопрос. Лакмус краснеет в растворе соли
Тест 26
Вопрос. Продуктом реакции пропена с хлором является
Тест 27
Вопрос. Сложный эфир образуется при взаимодействии глицина с
Тест 28
Вопрос. При работе с хлором соблюдают специальные меры безопасности, потому что он
Тест 29
Вопрос. Мономером для получения искусственного каучука по способу Лебедева служит
Тест 30
Вопрос. Согласно термохимическому уравнению реакции:
СН4(г) + 2О2(г) = CO2(г) + 2H2O(г) + 802 кДж
количество теплоты, выделившейся при сжигании 8 г метана, равно

