Характеристика химических свойств азидоводорода (азотистоводородной кислоты) и его солей
Задача 891.
Какими свойствами обладает азидоводород (азотистоводородная кислота) и его соли? Можно ли получить НN3 непосредственным взаимодействием азота и водорода? Ответ мотивировать.
Решение:
Азидоводород HN3 принадлежит к числу слабых кислот (КD = 3 . 10-5). Структурная формула HN3 имеет вид:
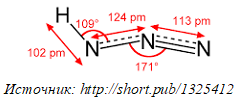
В водном растворе он диссоциирует на ионы Н+ и N3-:
HN3 ↔ H+ + N3–.
Соли азидоводорода хорошо растворимы в воде, например, азиды щелочных металлов. Сама азотистоводородная кислота и её соли (кроме солей щелочных и щелочно-земельных металлов) являются сильными взрывчатыми веществами.
Азидоводород HN3 получают действием ортофосфорной кислоты на азид натрия NaN3, который синтезируют из амида натрия:
2NaNH2 + N2O ↔
↔ NaN3 + NaOH + NH3;
3NaN3 + H3PO4 ↔ 3HN3 + Na3PO4.
Азидоводород можно получить из гидразина и азотистой кислоты:
N2H4 + HNO2 ↔ HN3 + 2H2O.
Действием серной кислоты на азиды металлов:
H2SO4 + 2NaN3 ↔ Na2SO4 + 2HN3.
Химические свойства азидоводорода
1) Как кислота азидоводород вступает в реакцию нейтрализации с основаниями:
HN3 + NaOH ↔ NaN3 + H2O.
2) Как окислитель азидоводород вступает в реакции окисления-восстановления:
HN3 + 3HI ↔ N2 + NH4I + I2;
3HN3 + Cu ↔ Cu(N3)2 + N2 + NH3;
HN3 + 3HCl ↔ NH4Cl + Cl2 + N2.
В этих реакциях азидоводород проявляет двойственную функцию как окислителя (понижат степень окисления азота до -3) и как восстановителя (повышат степень окисления азота до 0).
3) Азидоводород как восстановитель:
Восстановительные свойства азидоводорода в растворе обусловлены легкостью превращения его в молекулярный азот:
HN3 + H2O ↔ N2 + NH2OH;
10HN3 + 2KMnO4 + 3H2SO4 ↔
↔ 15N2 + 2MnSO4 + K2SO4 + 8H2O.
Азидоводород нельзя получить непосредственно из азота и водорода, так как азот и водород реагируют друг с другом с образованием аммиака.
Задача 892.
Закончить уравнения реакций и указать функцию HN3 (кислотную, окислительную, восстановительную) в каждой из них:
а) HN3 + KMnO4 + H2SO4 ↔ N2 + MnSO4 +;
б) HN3 + 3HI ↔ ;
в) HN3 + Cu ↔ ;
г) HN3 + NaOH ↔ .
Решение:
а) 10HN3 + 2KMnO4 + 3H2SO4 ↔
↔ 15N2 + 2MnSO4 + K2SO4 + 8H2O.
Азидоводород в данной реакции проявляет окислительную функцию, является восстановителем.
б) HN3 + 3HI ↔ N2 +NH4I + I2.
Азидоводород в данной реакции проявляет восстановительную функции, является окислителем.
в) 3HN3 + Cu ↔ Cu(N3)2 + N2 + NH3.
Азидоводород в данной реакции проявляет восстановительную функции, является окислителем .
г) HN3 + NaOH ↔ NaN3 + H2O.
В данной реакции азидоводород проявляет свойства кислоты.
Задача 893.
Вычислить рН 0,1 н. раствора NaN3 и степень гидролиза соли.
Решение:
NaN3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
N3- + H2O ↔ HN3 + OH–.
Избыток ионов ОН–, образующихся при гидролизе соли, придаёт раствору щелочную среду, рН > 7.
Рассчитаем степень гидролиза NaN3:
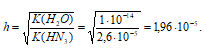
Находим рН раствора:
[OH–] = h . CM =
= (1,96 . 10-6) . 10-1 = 1,96 . 10-5;
рОН = -lg[OH–] =
= -lg1,96 . 10-6 = 6 – lg1,96 = 6 – 0,29 = 5,71;
рН = 14 – рОН = 14 – 5,71 = 8,29.
Ответ: 8,29; 1,96 . 10-6.
Задача 894.
Закончить уравнения реакций:
а) N2H4 . H2SO4 + KMnO4 + H2SO4 ↔ N2 +
б) N2H4 + HgCl2 ↔N2 + Hg2Cl2 +
Какова функция гидразина в этих реакциях?
Решение:
а) 5N2H4 . H2SO4 + 4KMnO4 + H2SO4 ↔
↔ 5N2↑ + 4MnSO4 + 2K2SO4 + 16H2O;
б) N2H4 + 4HgCl2 ↔ N2↑ + 2Hg2Cl2 + 4HCl.
В обеих реакциях гидразин проявляет свойства восстановителя, изменяя степень окисления от -2 до 0.

