Способы получения метафосфорной и фосфористой кислот
Задача 940.
Какие из перечисленных реакций могут быть использованы для получения метафосфорной кислоты:
а) Р2О5 + Н2О  ;
;
б) Р + HNO3(конц)  ;
;
в) Н3РО4 
г) Р2О5 + Н2О  .
.
Решение:
а) Метафосфорную кислоту можно получить при взаимодействии оксида фосфора(V) c водой при обычной температуре:
Р2О5 + Н2О  2НРО3.
2НРО3.
б) Р +5HNO3(конц)  H3PO4 + 5NO2↑ + H2O
H3PO4 + 5NO2↑ + H2O
При действии фосфора на концентрированную азотную кислоту образуются ортофосфорная кислота и оксид азота(II).
в) При разложении ортофосфорной кислоты получается метафосфорная кислота
Н3РО4  НРО3 + Н2О.
НРО3 + Н2О.
г) Р2О5 + 3Н2О  2Н3РО4
2Н3РО4
При нагревании Р2О5 свыше 80 0С с водой образуется ортофосфорная кислота.
Ответ: а, в.
Задача 941.
Какие из перечисленных реакций могут быть использованы для получения фосфористой кислоты:
а) Р2О3 + Н2О  ;
;
б) Р2О5 + Н2О ( ;
;
в) Р + HNO3(конц)  .
.
Решение:
а) Фосфористую кислоту можно получить растворением P4O6 (P2O3) в холодной воде:
Р2О3 + 3Н2О → 2Н3РО3.
б) При нагревании Р2О5 свыше 80 0С проходит реакция окисления-восстановления с образованием ортофосфорной кислоты:
Р2О5 + 3Н2О  2Н3РО4;
2Н3РО4;
в) Р +5HNO3(конц)  H3PO4 + 5NO2↑ + H2O.
H3PO4 + 5NO2↑ + H2O.
При действии фосфора на концентрированную азотную кислоту образуются ортофосфорная кислота и оксид азота(II).
Таким образом, из предложенных реакций фосфористая кислота образуется только при растворении Р2О3 в холодной воде (реакция а)
Ответ: а.
Задача 942.
Какое соотношение рН растворов солей SbCl3 (pH1) и BiCl3(pH2) равной молярной концентрации справедливо: a) рН1 < рН2; б) pH1 = рН2; в) pH1 > pH2? Потому что: 1) степень гидролиза зависит от концентрации раствора; 2) соль, образованная более слабым основанием, гидролизуется в большей степени.
Решение:
а) KД(Sb(OH)3) = 1 . 10-11
SbCl3 - соль слабого основания и сильной кислоты гидролизуется по катиону:
Sb(OH)2+ + H2O → Sb(OH)3 + H+.
Если учесть, что гидролиз соли протекает только по первой ступени можно рассчитать концентрацию ионов водорода по формуле:
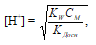
где [H+] – концентрация ионов водорода в растворе соли; СМ – молярная концентрация соли; КW – произведение растворимости воды; КДосн – константа диссоциации основания. С учетом того, что молярная концентрация соли равна 1 моль/л, получим:
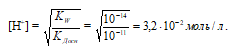
Рассчитаем рН1 раствора:
рН1 = -lg[H+] = -lg3,2 . 10-2 =
= 2 - lg3,2 = 2 – 0,50 = 1,5.
б) ПР((Bi(OH)3) = 1 . 10-11
BiCl3 - соль слабого основания и сильной кислоты гидролизуется по катиону:
Bi(OH)2+ + H2O - Bi(OH)3 + H+.
Рассчитаем молярную растворимость (S) основания Bi(OH)3. Выражение произведения растворимости гидроксида висмута(III) можно записать как
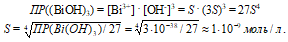
Рассчитаем концентрацию ионов водорода по формуле:
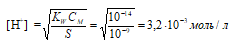
Рассчитаем рН2 раствора:
рН2 = -lg[H+] = -lg3,2 . 10-3 =
= 3 - lg3,2 = 3 – 0,50 = 2,5.
Таким образом, (рН1 < рН2) соль, образованная более слабым основанием, гидролизуется в большей степени.
Ответ: а2.

