Вычисление рН раствора, полученного смещением
Задача 549.
Рассчитать рН раствора, полученного смещением 25 мл 0,5 М раствора НСI, 10 мл 0,5 М раствора NаОН и 15 мл воды. Коэффициенты активности ионов принять равными единице.
Решение:
Рассчитаем количество HCl и NaOH по формуле n = (CM . V)/1000, где V – объём раствора, СМ – концентрация раствора, получим:
n(HCl) = (0,5 . 0,25)/1000 = 0,0125 моль;
n(NaOH) = (0,5 . 0,10)/1000 = 0,005 моль.
При смешении растворов кислоты и щёлочи произойдёт реакция нейтрализации:
NaOH + HCl ⇔ NaCl + H2O
Из уравнения реакции следует, что кислота и щёлочь взаимодействуют друг с другом в отношении 1 : 1, значит, в избытке взят раствор кислоты, поэтому в растворе останется некоторое количество HCl, получим:
n'(HCl) = n(HCl) - n(NaOH) = 0,0125 - 0,005 = 0,0075 моль.
Значит, 0,0075 молей HCl содержится в 50 мл раствора, полученного при смешении 25 мл кислоты, 10 мл щёлочи и 15 мл воды. Теперь рассчитаем молярную концентрацию раствора после смешения, получим:
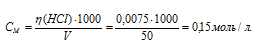
Учитывая, что коэффициент активности равен единице и, что концентрация ионов водорода в растворе одноосновной кислоты равна концентрации её, получим:
[H+] = CM(HCl) = 0,15 моль.
Тогда
pН = lg[Н+] = -lg1,5 . 10-1 =
= 1 - lg1,5 = 1 - 0,18 = 0,82.
Ответ: 0,82.
Задача 550.
Вычислить рН 0,1 н. раствора уксусной кислоты, содержащего, кроме того, 0,1 моль/л СН3СООNa. Коэффициенты активности ионов считать равными единице.
Решение:
Смесь уксусной кислоты и ацетата натрия представляет собой буферный раствор, рН которого не изменяется при разбавлении водой и при добавлении к нему небольших количеств сильного электролита. Концентрация ионов водорода в буферной системе определяется по формуле:
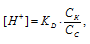
где
КD – константа диссоциации кислоты, СК – концентрация кислоты, СС - концентрация соли.
Тогда
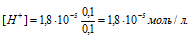
Теперь определим рН раствора:
pН = lg[Н+] = -lg1,8 . 10-5 =
= 5 - lg1,8 = 5 - 0,255 = 4,75.
рН буферного раствора можно определить по формуле:
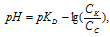
где pKD = -lgKD.
Отсюда
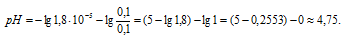
Ответ: 4,75.
Задача 551.
Как изменится рН, если вдвое разбавить водой: а) 0,2 М раствор НСI; б) 0,2 М раствор СН3СООН; в) раствор, содержащий 0,1 моль/л СН3СООН и 0,1 моль/л?
Решение:
а) HCl – сильный электролит, поэтому его степень диссоциации равна единице. Тогда концентрацию ионов водорода найдем по формуле [H+] = CM . , получим:
, получим:
[H+] = 0,2 . 1 = 0,2 моль.
Отсюда
pН1 = lg[Н+] = -lg2 . 10-1 =
= 1 - lg2 = 1 - 0,30 = 0,70.
При разбавлении раствора в двое, соответственно в два раза уменьшится концентрация раствора, тогда [H+] = 0,2/2=0,1моль/л.
Отсюда
pН'1 = lg[Н+] = -lg1 . 10-1 =
= 1 - lg1 = 1 - 0,0 = 1,0.
Находим изменение рН раствора:
pН'1 - pН1 = 1 - 0,70 = 0,30.
Таким образом, увеличение рН раствора составило 0,3.
б) Уксусная кислота как слабый электролит диссоциирует по схеме:
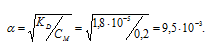
Рассчитаем концентрацию ионов водорода в растворе кислоты по формуле [Н+] = CM .  получим:
получим:
[Н+] = 0,2 . 9,5 . 10-3 = 1,9 . 10-3.
Отсюда
pН2 = lg[Н+] = -lg1,9 . 10-3 =
= 3 - lg1,9 = 3 - 0,29 = 2,71.
При разбавлении раствора в двое, соответственно в два раза уменьшится концентрация раствора, тогда
[Н+]'2 = 0,2/2=0,1 моль/л.
Определим степень диссоциации кислоты по формуле:
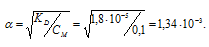
Тогда
pН'2 = lg[Н+] = -lg1.34 . 10-3 =
= 3 - lg1,9 = 3 - 0,13 = 2,87.
Находим изменение рН раствора:
pН'2 - pН2 = 2,87 - 1,71 = 0,16.
Таким образом рН раствора уксусной кислоты увеличилась на 0,16.
в) Смесь уксусной кислоты и ацетата натрия представляет собой буферный раствор, рН которого не изменяется при разбавлении водой и при добавлении к нему небольших количеств сильного электролита. Концентрация ионов водорода в буферной системе определяется по формуле:
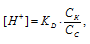
где
КD – константа диссоциации кислоты, СК – концентрация кислоты, СС - концентрация соли.
Тогда
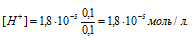
При разбавлении буферной смеси отношение концентраций кислоты и соли не изменится, поэтому рН смеси тоже не изменится и будет равно:
pН = lg[Н+] = -lg1,8 . 10-5 = 5 - lg1,8 = 5 - 0,255 = 4,75.
Ответ: а) увеличится на 0,3; б) увеличилась на 0,16; в) не изменится.

