Состав и приготовление хромокалиевых квасцов(III)
Задача 1089.
Как приготовить хромокалиевые квасцы, если в качестве исходного вещества взять дихромат калия? Найти массу К2Сr2O7, необходимую для получения 1 кг квасцов.
Решение:
Хромокалиевые квасцы представляют собой двойную соль хрома и калия – KCr(SO4)2 . 12H2O, которую можно получить, пропуская диоксид серы через концентрированный раствор дихромата калия, содержащий достаточное количество серной кислоты, то образуются эквивалентные количества сульфатов калия и хрома:
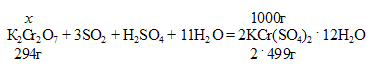
М(К2Сr2O7) =294 г/моль.
М(KCr(SO4)2 . 12H2O) = 499г/моль.
Рассчитаем массу К2Сr2O7, необходимую для получения 1 кг квасцов:
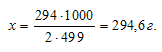
Ответ: 294,6г.
Хроматы и дихроматы
Задача 1090.
Почему при взаимодействии соли бария с растворами хромата и дихромата калия выпадают осадки одинакового состава?
Решение:
При взаимодействии соли бария с хроматом калия происходит реакция обмена с образованием жёлтого кристаллического осадка, растворимого в сильных кислотах:
K2CrO4 + BaCl2 = BaCrO4↓ + 2KCl.
Соли бария реагируют с дихроматом калия с образованием жёлтого кристаллического осадка, растворимого в сильных кислотах и нерастворимого в уксусной кислоте:
К2Сr2O7 + 2BaCl2 + H2O = 2BaCrO4↓ + 2KCl + 2HCl.
Условия проведения реакции: а) нагревание; б) присутствие ацетата натрия (ацетатная буферная смесь рН = 3-5) для связывания выделяющихся ионов водорода и смещения равновесия в системе дихромат-хромат-ионы:
Сr2O72- + H2O ⇔ 2CrO42- + 2Н+ (Н+ + СН3СОО– ⇔ СН3СООН).
Реакцию применяют для обнаружения ионов бария (ионы кальция и стронция не мешают, т.к. их хроматы растворимы в уксусной кислоте) и отделения его от этих ионов в пределах третьей группы катионов.

