Расчет массы сульфата железа (II), идущего на окисление перманганатом калия в кислой среде
Задача 646.
Какую массу сульфата железа (II) можно окислить в кислой среде с помощью 20 мл 0,1 н. раствора перманганата калия?
Решение:
Уравнения полуреакций окисления-восстановления:
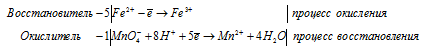
Из чего следует, что fЭ(FeSO4) = 1/1, a fЭ(KMnO4) = 1/5 молей.
Тогда
МЭ(FeSO4) = M(FeSO4)/1 =
= 151,911/1 = 151,911 г/моль;
МЭ(KMnO4) = M(KMnO4)/5 =
= 158,036/5 = 31,6072 г/моль.
Находим количество молей, содержащихся в 20 мл 01 н раствора KMnO4:
1000 : 0,1 = 20 : х;
х = (20 . 1)/1000 = 0,002 моля.
Согласно закону эквивалентов вещества взаимодействуют друг с другом в эквивалентных количествах.
Теперь рассчитаем массу сульфата железа (II), которую можно окислить перманганатом калия:
m(FeSO4) = MЭ(FeSO4) . n(FeSO4) =
= 151,911 . 0,002 = 0,304 г.
Ответ: 0,304 г.
Задача 647.
Вычислить массу йода и измеренный при нормальных условиях объем монооксида азота, выделившихся при добавлении 30 мл 0,2 н. раствора КNO2 к избытку подкисленного раствора КI.
Решение:
M(I2) = 253,808г/моль; VM = 22,4л/моль.
Уравнения полуреакций окисления-восстановления:
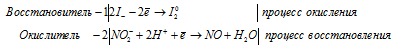
Из уравнения следует, что fЭ(NO) = 1/1, a fЭ(I2) = 1/2 молей.
Тогда
МЭ(I2) = M(I2)/2 = 253,808/2 =
= 126,904 г/моль.
В 1 л раствора содержится 0,2 эквивалента КNO2, а в 30 мл раствора: 0,2 . 0,03 = 0,006 эквивалента. Согласно закону эквивалентов, при восстановлении этого количества КNO2 будет окислено такое же количество KI, и будет получено такое же количество эквивалентов I2 и NO.
Найдём массу йода:
m(I2) = M(I2) . n(I2) =
=126,904 . 0,006 = 0,7614 г.
Находим объём монооксида азота:
V(NO) = VM . n(NO) = 22,4 . 0,006 = 0,134 л.
Ответ: 0,7614 г I2; 0,1344 л NO.
Задача 648.
Чему равна нормальность 10%-ного (по массе) раствора КIО3 (р = 1,052 г/мл), если он восстанавливается до свободного йода?
Решение:
Находим массу 1 л раствора по формуле:
m(р-ра) = V . p =
= 1000 . 1,052 = 1052 г.
Теперь определим массу KClO3, содержащегося в 1л 10%-ного (по массе) его раствора:
m(KClO3) = 0,1 . 1052 = 105,2 г.
Из уравнения полуреакции восстановления KIO3.
IO3- + 6H+ + 5е = I20 + 3H2O
следует, что
fЭ(КIO3 ) = 1/5; МЭ(КIO3) =
= M(KIO3) = 214/5 = 42,8г/моль.
Рассчитаем количество эквивалентов KClO3 в 1л раствора его:
n(КClO3) = 105,2/42,8 = 2,46 молей.
Нормальность раствора – это количество эквивалентов, содержащихся в 1 л раствора. тогда получим СN = 2,46 N.
Ответ: 2,46 N.
Задача 649.
Железная пластинка погружена в раствор CuSO4. После окончания реакции масса пластинки увеличилась на 2 грамма. Найти массу выделившейся из раствора меди.
Решение:
Согласно закону эквивалентов при окислении железа выделяется эквивалентное количество меди.
Найдём эквивалентные массы железа и меди при реакции:
Fe + CuSO4 = FeSO4 + Cu
Из уравнений полуреакций окисления-восстановления:
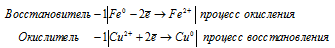
следует, что fЭ(Fe) = 1/2; fЭ(Cu) = 1/2; МЭ(Fe) = M(Fe)/2 = 27,9225г/моль; МЭ(Cu) = M(Cu) = 63,546/2 = 31,773г/моль.
Исходя из этого, определим увеличение массы железной пластинки при выделении из раствора меди, получим:
31,773 – 27, 9225 = 3,8505 г.
Таким образом, при взаимодействии 1 моля железа с 1 молем медного купороса выделяется 31,773 г меди, и при этом железная пластинка увеличивается на 3,8505 г.
Массу меди, выделившейся из раствора, если масса железной пластинки увеличилась на 2 г, рассчитаем из пропорции:
31,773 : 3,8505 = х : 2;
х = (2 . 31,773)/3,8505 = 16,5033 г.
Ответ: 16,5033 г.

