Что такое ферриты и что такое ферраты
Как получают ферриты и ферраты
Задача 1126.
Какие соединения называются ферритами и ферратами? Привести примеры.
Решение:
Ферриты – соли не существующей в свободном состоянии железистой кислоты HFeO2, например феррит натрия NaFeO2. Обычно ферриты натрия или калия получают сплавлением оксида железа (III) с карбонатом натрия или калия:
Fe2O3 + Na2CO3 = 2NaFeO2 + CO↑
В технике ферритами называют продукты спекания порошков оксида железа (III) и некоторых оксидов двухвалентных металлов (Zn, Ni, Mn):
Fe2O3 + ZnO = Zn(FeO2)2
Спекание производится при температуре 1000 – 1400 0С. Ферриты обладают магнитными свойствами и высоким электрическим сопротивлением.
Ферраты – соли железной кислоты H2FeO2. Здесь железо находится в своей степени окисления +6. Если нагреть стальные опилки или оксид железа(III) с нитратом и гидроксидом калия, то образуется сплав, содержащий феррат калия: K2FeO4:
Fe2O3 + 4KOH + 3KNO3 =
= K2FeO4 + 3KNO2 + 2H2O
Уравнения электронного баланса:
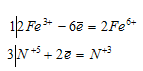
При растворении сплава в воде получается красно-фиолетовый раствор, из которого действием хлорида бария можно осадить нерастворимый в воде феррат бария BaFeO4:
K2FeO4 + BaCl2 = BaFeO4↓+ 2KCl.
Все ферраты – сильные окислители (более сильные, чем перманганаты). H2FeO4 и FeO3 в свободном состоянии не получены.
Вычисление молярной концентрации сульфата железа (II) в анализируемом растворе железного купороса
Задача 1127.
Железо, содержавшееся в 10 мл анализируемого раствора FeSO4, окислено до железа (III) и осаждено в виде гидроксида. Масса прокаленного осадка оказалась равной 0,4132 г. Вычислить молярную концентрацию FeSO4 в исходном растворе.
Решение:
M(FeSO4) = 152 г/моль;
M Fe2O3 = 160 г/моль.
При прокаливании (350 - 400 0C) гидроксиды железа (III) образуя оксид железа (III):
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
В 1 моль Fe2O3 содержится 112 г Fe. Исходя из этого, рассчитаем массу железа в 0,4132г оксида железа (III), составив пропорцию:
Fe2O3 160г — Fe 112г;
Fe2O3 0,4132г — Fe xг
х = (0,4132г . 112)/160 = 0,289г.
Найдем количество FeSO4, учитывая что в 1 моле его содержится 56 г Fe, получим:
η(FeSO4) = 0,289/56 = 0,005175 моль.
Теперь вычислить молярную концентрацию FeSO4 в исходном растворе из пропорции:
10 мл — 0,005175 моль;
1000 мл — y моль
y = (1000 . 0,005175)/10 = 0,517моль.
Таким образом, молярность раствора FeSO4 равна 0,517М.
Ответ: 0,517 М.

