Особенности электронного строения карбонильных соединений железа и никеля
Карбонил железа, карбонил никеля
Задача 1128.
Описать электронное строение карбонильных соединений железа и никеля. Для чего применяются эти соединения?
Решение:
Оксид углерода(II) соединяется со многими металлами, образуя карбонилы металлов, например, карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4. Эти два вещества представляют собой летучие, весьма ядовитые жидкости. Большинство карбонилов металлов - кристаллические вещества. Применяются для получения чистых металлов. Подлежащий очистке металл, например, никель нагревают в атмосфере СО, находящегося под давлением около 20 МПа. При этом никель взаимодействует с СО, образуя летучий тетракарбонил никеля Ni(CO)4 (температура кипения 42 0С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся Ni(CO)4 отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением чистого металла в осадке и газообразного СО. При очистке железа аналогичным образом осуществляется процесс синтеза карбонила железа Fe(CO)5 (105 0С). Карбонилы являются катализаторами важных химических реакций. Наибольшее значение имеют карбонилы никеля, кобальта и железа.
Химические связи в молекулах карбонилов металлов образованы по донорно-акцепторному механизму за счёт неспаренных электронных пар молекулы СО и свободных орбиталей возбуждённого атома металла. Например, у возбуждённого атома железа имеются пять незанятых орбиталей:
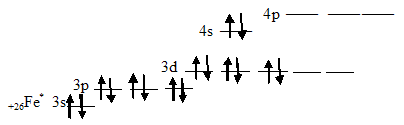
Поэтому молекула карбонила железа имеет состав, отвечающий формуле Fe(CO)5.
У возбуждённого атома никеля имеются четыре незанятых орбиталей:
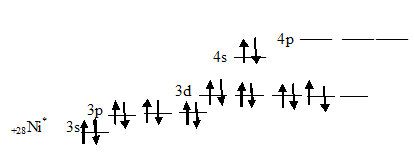
Поэтому молекула карбонила никеля имеет состав, отвечающей формуле Ni(CO)4.
Окислительно-восстановительные свойства железа, кобальта, никеля
Задача 1129.
Как изменяется устойчивость к окислению в ряду Fe(II) — Со(II) — Ni(II)? Как изменяется окислительная способность в ряду Fe(III) — Сo(III) — Ni (III)?
Решение:
а) Устойчивость к окислению в ряду Fe(II) — Со(II) — Ni(II) при переходе от железа к никелю увеличивается. Соединения железа(II) обладают восстановительными свойствами и малой устойчивостью из-за склонности к переходу в соединения железа(III) с более устойчивой степенью окисления. В связи с этим гидроксид железа(II) уже на воздухе быстро окисляется, превращаясь в красновато-коричневый осадок Fe(OH)3. В присутствии окислителей (пероксида водорода, гипохлоридов или хлора) окисление происходит мгновенно. Соединения Со(II) и Ni(II) более устойчивы. Гидроксид Со(OH)2 медленно окисляется на воздухе, быстрее под действием окислителей. Гидроксид никеля(II) окисляется только под действием сильных окислителей. Это можно объяснить тем, что с увеличением порядковых номеров элементов в триаде, с увеличением зарядов ядер атомов и числа электронов, усиливается притяжение электронов к ядру, что приводит к уменьшению радиусов ионов в ряду Fe(II) — Со(II) — Ni(II). При уменьшении радиусов ионов усиливается устойчивость к окислению.
б) Окислительная способность в ряду Fe(III) — Сo(III) — Ni (III) усиливается. В степени окисления +3 из элементов семейства железа наиболее устойчивы соединения железа. Из-
Известно небольшое число простых соединений Со(III) и Ni(III), так как они относительно неустойчивы, проявляют окислительные свойства, легко гидролизуются. Это можно объяснить тем, что с увеличением порядковых номеров элементов в триаде, с увеличением зарядов ядер атомов и числа электронов, усиливается притяжение электронов к ядру, что приводит к уменьшению радиусов ионов в ряду Fe(III) — Сo(III) — Ni (III). При уменьшении радиусов ионов с одинаковыми зарядами усиливается способность к присоединению электронов.

