Составьте электронные уравнения процессов, происходящих на электродах
Решение задач на электролиз растворов солей
Задание 268.
Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74 А.
Решение:
Стандартный электродный потенциал системы Zn2+ + 2  = Zn0 (-0,763 В) значительно отрицательне потенциала водородного электрода в кислой среде (0,00 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Zn2+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
= Zn0 (-0,763 В) значительно отрицательне потенциала водородного электрода в кислой среде (0,00 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Zn2+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
2Н2О + 2  = Н2↑ + 2ОН-
= Н2↑ + 2ОН-
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О - 4 = О2↑ + 4Н+,
= О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- - 2 = 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
= 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Силу тока вычисляем из уравнения Фарадея относительно выделившегося объёма газа, имея в виду, что 5 ч = 18000 с и VЭ(О2) = 5,6 лг/моль, получим:
I = V . F/VЭ . t =
= 6 . 96500/5,6 . 18000 = 5,74 A.
Здесь V – объём выделившегося газа, л; VЭ – эквивалентный объём газа, л/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: I = 5,74 А.
Задание 269.
Электролиз раствора СuSO4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анодов. Ответ: 94,48%.
Решение:
Массу теоретического выхода меди вычислим из уравнения Фарадея, имея в виду, что 4 ч = 14400 с и МЭ(Cu) = 31,77 г/моль, получим:
m(Cu) = МЭ(В) . I . t/F =
= 31,77 . 50 . 14400/96500 = 237,04 г.
Здесь m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Выход по току (отношение массы выделившегося вещества к теоретически возможной) равен:
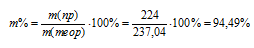
Стандартный электродный потенциал системы Cu2+ + 2  = Cu0 (+0,34 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае при электролизе соли на угольных электродах, на катоде будет происходить электрохимическое восстановление меди Cu2+:
= Cu0 (+0,34 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае при электролизе соли на угольных электродах, на катоде будет происходить электрохимическое восстановление меди Cu2+:
Cu2+ + 2  = Cu0
= Cu0
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О - 4 = О2↑ + 4Н+,
= О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- - 2  = 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
= 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
При электролизе соли медного купороса на медном аноде на катоде будет электрохимическое восстановление меди Cu2+. На аноде будет происходить электрохимическое окисление меди, приводящее к выделению в анодное пространство ионов Cu2+, поскольку отвечающий этой системе стандартный электродный потенциал (+0,34 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О - 4  = О2↑ + 4Н+
= О2↑ + 4Н+
т. е. в данном случае при электролизе будет происходить растворение медного анода и отложение меди на катоде. Электрохимические процессы при данном типе электролиза:
Катод: Cu2+ + 2  = Cu0;
= Cu0;
Анод: Cu0 - 2  = Cu2+
= Cu2+
Ответ: m% = 94,49%.
Задание 270.
Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вsчислите массу вещества, выделившегося на катоде и аноде? Ответ: 0,56 г; 71,0 г.
Решение:
Стандартный электродный потенциал системы Na+ +  = Na0 (-2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
= Na0 (-2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
2Н2О + 2  = Н2↑ + 2ОН-
= Н2↑ + 2ОН-
На аноде будет происходить электрохимическое окисление ионов I-, приводящее к выделению йода:
2I- - 2  = I2.
= I2.
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О - 4  = О2↑ + 4Н+
= О2↑ + 4Н+
Массу веществ, выделившихся на электродах находим из уравнения Фарадея, имея в виду, что 2,5 ч = 9000 с и МЭ(Н2) = 1 г/моль, МЭ(I2) = 126,9 г/моль получим:
m(B) = МЭ(B) . I . t/F;
m(H2) = МЭ(H2). I . t/F =
= 1 . 6 . 9000/96500 = 0,56 г;
m(I2) = МЭ(I2) . I . t/F =
= 126,9 . 6 . 9000/96500 = 71,00 г.
m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Ответ: m(I2) = 0,56 г; 71,0 г.

