Составление уравнений окислительно-востановительных реакций
Задача 629.
Закончить уравнения реакций:
а) KI + Fe2(SO4)3 → I2 +
б) KI + CuCl2 → CuCl +
в) SnCl2 + HgCl2 → Hg2Cl2 +
Решение:
а) KI + Fe2(SO4)3 → I2 +
Уравнения полуреакций:
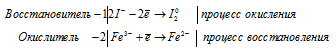
Ионно-молекулярная форма процесса:
2I- + 2Fe3+ = I2 + 2Fe2+
После приведения членов обеих частей уравнения, получим:
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4.
б) KI + CuCl2 → CuCl +
Уравнения полуреакций:
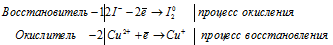
Ионно-молекулярная форма процесса:
2I- + 2Cu2+ = I2 + 2Cu+
После приведения членов обеих частей уравнения, получим:
2KI + 2CuCl2 = I2 + 2CuCl + 2KCl.
в) SnCl2 + HgCl2 → Hg2Cl2 +
Уравнения полуреакций:
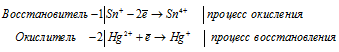
Ионно-молекулярная форма процесса:
Sn2+ + 2Hg2+ = Sn4+ + 2Hg+
После приведения членов обеих частей уравнения, получим:
SnCl2 + 2HgCl2 = SnCl4 + Hg2Cl2.
Задача 630.
Закончить уравнения реакций, в которых окислитель (или восстановитель) дополнительно расходуется на связывание продуктов реакции:
а) HgBr + KMnO4 → MnВr2 +
б) HCl + CrO3 → Cl2 +
в) NH3(избыток) + Br2 → N2 +
г) Cu2O + HNO3 → NO +
Решение:
а) HgBr + KMnO4 → MnВr2 +
Уравнения полуреакций:
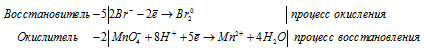
Ионно-молекулярная форма процесса:
10Br- + 2MnO4- + 16H+ = 2Mn2+ + 5Br20 + 8H2O.
После приведения членов обеих частей уравнения, получим:
16HBr 2KMnO4 = 2MnBr2 + 5Br2 + 2KBr + 8H2O.
б) HCl + CrO3 → Cl2 +
Уравнения полуреакций:
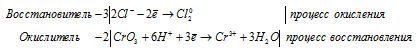
Ионно-молекулярная форма процесса:
6Cl- + 2CrO3 + 12H+ = 2Cr3+ + 3Cl20 + 6H2O.
После приведения членов обеих частей уравнения, получим:
12HCl + 2CrO3 = 2CrCl2 + 3Cl2 + 6H2O.
в) NH3(избыток) + Br2 → N2 +
Уравнения полуреакций:
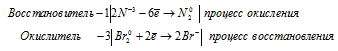
Ионно-молекулярная форма процесса:
2N-3 + 3Br20 = 6Br- + N20
После приведения членов обеих частей уравнения, получим:
2NH3 + 3Br2 = 6HBr + N2.
г) Cu2O + HNO3 → NO +
Уравнения полуреакций:
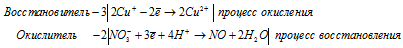
Ионно-молекулярная форма процесса:
6Cu+ + 2NO3- + 8H+ = 6Cu2+ + 2NO + 4H2O.
После приведения членов обеих частей уравнения, получим:
Cu2O + 8HNO3 = 3CuO + 2NO + 3Cu(NO3)3 + 4H2O.

