Вычисление потери от растворимости солей при промывании их указанным объёмом промывной жидкости
Вычисление потери от растворимости вольфрамата кальция при промывании его указанным объёмом воды
Задача 258.
Вычислить потерю от растворимости осадка в граммах и процентах при промывании его указанным объёмом промывной жидкости. Осадок CaWО4, массой 0,10 г, ПрCaWО4) = 1,6 . 10-9; промывная жидкость Н2О, объёмом 500 см3.
Решение:
M(CaWО4) = 287,918 г/моль.
Вычислим растворимость в молях на 1 дм3 CaWО4, обозначив её через "х", получим:
х = √1,6 . 10-9 = 4,0 . 10-5 моль/дм3.
Произведение растворимости сульфата кальция - величина справочная
Пр(CaWО4) = 1,6 . 10-9, поскольку:
Пр(CaWО4) = [Ca2+] . [WО42-] = x2 = 1,6 . 10-9.
Откуда
Потери (г) за счёт растворимости равны:
(4,0 . 10-4 . 287,918 . 500)/1000 = 5,76 . 10-3 г CaWО4.
Потери в процентах равны:
0,10 г CaWО4 -------------------- 100%
5,76 . 10-3 г CaWО4 ------------ х
х = [(5,76 . 10-3) . 100%]/0,10 = 5,76%
Таким образом, при промывании осадка CaWО4 500 см3 воды мы вносим существенную погрешность в результате потерь от растворимости.
Ответ: 5,76 . 10-3 г; 5,76%.
Вычисление потери от растворимости карбоната кальция промывании его указанным объёмом карбоната натрия
Задача 259.
Вычислить потерю от растворимости осадка в граммах и процентах при промывании его указанным объёмом промывной жидкости. Осадок СаСО3, массой 0,20г, Пр(СаСО3) = 4,8 . 10-9; промывная жидкость Na2CO3, объёмом 200 см3, концентрацией 0,5%.
Решение:
Mr(CaCO3) = 100,078; Мr(Na2СО3) = 105,98.
Рассчитаем массу Na2CO3 в 1дм3 раствора из пропорции:
100 : 0,5 = 1000 : х;
х = (1000 . 0,5)/100 = 5 г Na2CO3.
Рассчитаем концентрацию раствора Na2CO3:
CM(Na2CO3) = m(Na2CO3)/M(Na2CO3) =
= 5/105,98 = 0,047 моль/дм3.
Обозначим растворимость CaCО3 моль/дм3 через "х", тогда
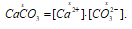
Na2CO3 – сильный электролит, и поэтому:
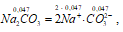
Концентрация ионов CO32- равна концентрации соли:
[CO32-] = 0,047 моль/дм3.
Так как ионы Са2+ поступают в раствор только из осадка, то [Cа2+] = х, а ионы CO32- из осадка и из промывной жидкости, тогда [CO32-] = х + 0,047. Поскольку х << 0,047, то можно считать, что вся концентрация ионов CO32- в растворе практически равна его концентрации в промывной жидкости - [[CO32-] = 0,047 моль/дм3, а значением "х", как очень малой величиной, мы можем пренебречь.
Поскольку Пр(CaСO3) = [Ca2+] . [CO32-], то, подставив в эту формулу соответствующие значения концентраций ионов, находим:
Пр(CaСO3) = [Ca2+] . [CO32-] =
= x . x = x2 = 4,8 . 10-9;
Пр(CaСO3) = х . 0,047.
Откуда
x = Пр(CaСO3)/0,047 = 4,8 . 10-9/0,047 =
= 1,02 . 10-7 моль/дм3.
Потери (г) за счёт растворимости равны:
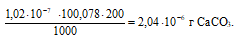
Потери в процентах равны:
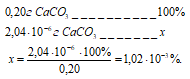
Таким образом, при промывании осадка CaСO3 200 см3 0.5% раствора Na2CO3 мы вносим незначительную погрешность в результате потерь от растворимости.
Ответ: 2,04 . 10-6 г; 1,02 . 10-3%.
Задачи на расчт потери от растворимости соли:
1. Расчт потери от растворимости карбоната серебра
2. Расчт потери от растворимости хромата свинца
3. Расчт потери от растворимости оксалата бария

