Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296.
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu2+ - восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Уравнения электронного баланса:
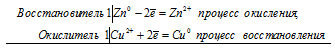
Zn0 + Сu2+ = Zn2+ + Cu0
Zn + CuSO4 = ZnSO4 + Cu
б) Электрохимические процессы при реакции железа и сульфата меди
Уравнения электронного баланса:
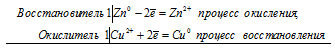
Fe0 + Сu2+ = Fe2+ + Cu0
Fe + CuSO4 = FeSO4 + Cu
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn0 -2 = Zn2+
= Zn2+
Катодный процесс: Cu2+ + 2 = Cu0
= Cu0
Задание 297.
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н+ + 2 = Н2↑
= Н2↑
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, - это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н+ + 2 = Н2↑
= Н2↑
При повышении рН раствора уменьшается концентрация ионов водорода Н+ и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н+ + 2 = Н2↑ и 1/2O2 + H2O + 2
= Н2↑ и 1/2O2 + H2O + 2 = 2OH- влево, т. е. в сторону увеличения концентрации ионов Н+ и уменьшения концентрации ионов ОН-.
= 2OH- влево, т. е. в сторону увеличения концентрации ионов Н+ и уменьшения концентрации ионов ОН-.
Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn0 -2 = Zn2+
= Zn2+
Катод: 1/2O2 + H2O + 2 = 2OH-
= 2OH-
Анод: Zn0 -2 = Zn2+
= Zn2+
Катод: 1/2O2 + H2O + 2 = 2OH-
= 2OH-
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn2+:
Zn0 -2 = Zn2+
= Zn2+
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn0 -2 = Zn2+
= Zn2+
Катодный процесс: в кислой среде: 2Н+ + 2 = Н20; в нейтральной или щелочной среде: 1/2O2 + H2O + 2
= Н20; в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH-
= 2OH-
В нейтральной среде или в щелочной ионы цинка Zn2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.

