Определение парамагнитных и диамагнитных свойств комплексных ионов
Задача 755.
Какие из перечисленных ионов парамагнитны:
а) [Fe(CN)6]3-; б) [Fe(CN)6]4-; в) [Co(H2O)6]2+; г) [Co(H2O)6]3+; .
Потому что: 1) лиганд создает сильное поле, и шесть d-электронов заполняют три орбитали 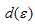 - подуровня; 2) лиганд содает слабое поле, и все орбитали заполняются в соответствии с правилом Хунда; 3) центральный ион содержит нечетное число электронов.
- подуровня; 2) лиганд содает слабое поле, и все орбитали заполняются в соответствии с правилом Хунда; 3) центральный ион содержит нечетное число электронов.
Решение:
а) [Fe(CN)6]3-. На 3d-подуровне иона Fe3+ находятся пять электронов и все они не спаренные:
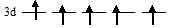
В октаэдрическом поле лигандов происходит расщепление d-подуровня. В случае [Fe(CN)6]3- лиганд сильного поля (ион CN-) вызывает значительное расщепление d-подуровня и значение  (энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение всех пяти электронов на
(энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение всех пяти электронов на 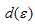 -подуровне в соответствии со схемой:
-подуровне в соответствии со схемой:

В результате в ионе [Fe(CN)6]3- содержится один неспаренный электрон, сообщающий ему парамагнитные свойства.
б) б) [Fe(CN)6]4-. На 3d-подуровне иона Fe2+ находятся шесть электронов из них четыре неспаренные:
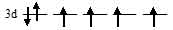
В октаэдрическом поле лигандов происходит расщепление d-подуровня. В случае [Fe(CN)6]4-лиганд сильного поля (ион CN-) вызывает значительное расщепление d-подуровня и значение  (энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение всех шести электронов на
(энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение всех шести электронов на 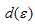 -подуровне в соответствии со схемой:
-подуровне в соответствии со схемой:
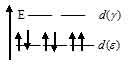
В результате в ионе [Fe(CN)6]4- не содержится неспаренных электронов, поэтому ион диамагнитен.
в) [Co(H2O)6]2+. На 3d-подуровне иона Со2+ находятся семь электронов из них три неспаренных:
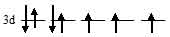
В октаэдрическом поле лигандов происходит расщепление d-подуровня. В случае [Co(H2O)6]2+ лиганд сильного поля (Н2О) вызывает значительное расщепление d-подуровня и значение  (энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение шести электронов на
(энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение шести электронов на 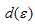 -подуровне и одного на
-подуровне и одного на 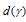 -подуровне в соответствии со схемой:
-подуровне в соответствии со схемой:
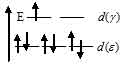
В результате в ионе [Co(H2O)6]2+ содержится один неспаренных электрон, сообщающий ему парамагнитные свойства.
г) [Co(H2O)6]3+. На 3d-подуровне иона Со3+ находятся шесть электронов из них четыре неспаренные:
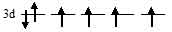
В октаэдрическом поле лигандов происходит расщепление d-подуровня. В случае [Co(H2O)6]3+ лиганд сильного поля (Н2О) вызывает значительное расщепление d-подуровня и значение  (энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение всех шести электронов на
(энергия расщепления d-подуровня) будет столь значительно, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически наиболее выгодно расположение всех шести электронов на 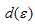 -подуровне в соответствии со схемой:
-подуровне в соответствии со схемой:
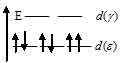
В результате в ионе [Co(H2O)6]3+ не содержится неспаренных электронов, поэтому ион диамагнитен.
д) д) [Fe(F)6]4-. На 3d-подуровне иона Fe2+ находятся шесть электронов из них четыре неспаренные:
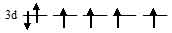
В октаэдрическом поле лигандов происходит расщепление d-подуровня. В случае д) [Fe(F)6]4- лиганд слабого поля (ион F-) вызывает незначительное расщепление d-подуровня и значение  (энергия расщепления d-подуровня) будет столь мало, что не превысит энергию межэлектронного отталкивания спаренных электронов, поэтому d-орбитали заполняются в соответствии с правилом Хунда сообразно схеме:
(энергия расщепления d-подуровня) будет столь мало, что не превысит энергию межэлектронного отталкивания спаренных электронов, поэтому d-орбитали заполняются в соответствии с правилом Хунда сообразно схеме:
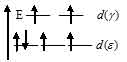
В результате в ионе д) [Fe(F)6]4- содержится четыре неспаренных электронов, поэтому ион парамагнитен.
Ответ: а3; в3; г2; д2.
Задача 756.
Одинакова ли пространственная структура диамагнитного иона [NiCl4]2- и парамагнитного иона [PdCl4]2-: а) одинакова; б) неодинакова? Потому что: 1) электронная конфигурация валентных орбиталей центральных ионов выражается общей формулой nd8; 2)  - связи образуются при участии неодинаковых акцепторных орбиталей сравниваемых центральных ионов.
- связи образуются при участии неодинаковых акцепторных орбиталей сравниваемых центральных ионов.
Решение:
а) [NiCl4]2-. Электронная конфигурация иона Ni2+ (...3s23p63d8). Графическая схема заполнения электронами валентных орбиталей в соответствии с правилом Хунда имеет вид:
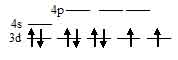
Ион [NiCl4]2- диамагнитен, следовательно, в нём сохраняются только спаренные электроны на 3d-подуровне, а акцепторными орбиталями (эти орбитали обозначены крестиком) служат одна 4s- и три 4р-орбитали иона Ni2+:
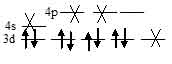
Таким образом, образование иона [NiCl4]2- сопровождается dsp2 – гибридизацией АО никеля. Пространственная структура этого иона – тетраэдр.
б) [PdCl4]2-. Электронная конфигурация иона Рd2+ (...3s23p63d8). Графическая схема заполнения электронами валентных орбиталей в соответствии с правилом Хунда имеет вид:
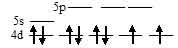
Ион [PdCl4]2- парамагнитен, следовательно, в нём сохраняются неспаренные электроны на 4d-подуровне, а акцепторными орбиталями (эти орбитали обозначены крестиком) служат одна 5s- и три 5р-орбитали иона Pd2+:
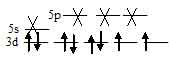
Таким образом, образование иона [PdCl4]2- сопровождается sp3 – гибридизацией АО палладия. Пространственная структура этого иона – плоский квадрат.
Ответ: б2).

