Определение молекулярных (мольных) масс веществ в газообразном состоянии
Задача 80.
Масса 200 мл ацетилена при нормальных условиях равна 0,232 г. Определить мольную массу ацетилена.
Решение:
1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4 л. Зная массу и объём ацетилена при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
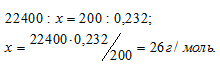
Ответ: 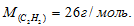
Задача 81.
Вычислить мольную массу газа, если масса 600 мл его при нормальных условиях равна 1,714 г.
Решение:
1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4л. Зная массу и объём ацетилена при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
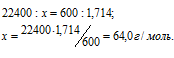
Ответ: 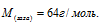
Задача 82.
Масса 0,001 м3 газа (0 °С, 101,33 кПа) равна 1,25 г. Вычислить: а) мольную массу газа; б) массу одной молекулы газа.
Решение:
а) Выразив данные задачи в системе единиц СИ (Р = 10,133 • 104 Па; V = 10 • 10–4 м3; m = 1,25 • 10-3 кг; Т = 273 К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа:
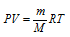
Здесь
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль.
Отсюда
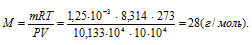
б) 1 моль любого вещества содержит 6,02 . 1023 частиц (атомов, молекул), тогда масса одной молекулы рассчитывается из соотношения:
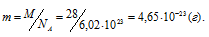
Ответ: М = 28 г/моль; m = 4,65 . 10-23 г.
Задача 83.
Масса 0,001 м3 газа при нормальных условиях равна 0,0021кг. Определить мольную массу газа и его плотность по воздуху.
Решение:
1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4 л. Зная массу и объём газа при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
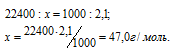
Плотность газа по воздуху равна отношению мольной массы данного газа к мольной массе воздуха:
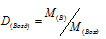
Здесь
D - плотность газа по воздуху; - мольная масса газа; - мольная масса воздуха (29 г/моль). Тогда
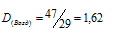
Ответ: 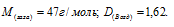
Задача 84.
Плотность этилена по кислороду равна 0,875. Определить молекулярную массу газа.
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
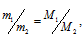
где
m1/m2 - относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
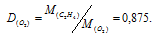
Мольная масса кислорода равна 32 г/моль. Тогда
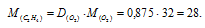
Ответ: 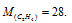
Задача 85.
Масса 0,001 м3 некоторого газа при нормальных условиях равна 0,00152 кг, а масса 0,001 м3 азота составляет 0,00125 кг. Вычислить молекулярную массу газа, исходя: а) из его плотности относительно азота; б) из мольного объема.
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
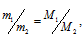
где
m1/m2 - относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
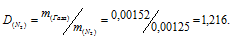
Мольная масса азота равна 28 г/моль. Тогда
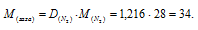
б) 1 моль любого газа при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) занимает объём равный 22,4 л. Зная массу и объём газа при нормальных условиях рассчитаем мольную массу его, составив пропорцию:
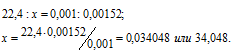
Ответ: М(Газа) = 34 г/моль.
Задача 86.
Из скольких атомов состоят в парах молекулы ртути, если плотность паров ртути по воздуху равна 6,92?
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
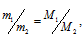
где
m1/m2 - относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
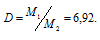
Мольная масса воздуха равна 29 г/моль. Тогда
M1 = D . M2 = 6,92 . 29 = 200,6 г/моль.
Зная, что Ar(Hg) = 200,6 г/моль, находим количество атомов (n), из которых состоит молекула ртути:
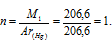
Таким образом, молекула ртути состоит из одного атома.
Ответ: из одного.
Задача 87.
При некоторой температуре плотность паров серы по азоту равна 9,14. Из скольких атомов состоит молекула серы при этой температуре?
Решение:
Из закона Авогадро следует, что при одном и том давлении и одинаковых температуре массы равных объёмов газов относятся как их молекулярные массы:
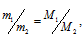
где
m1/m2 - относительная плотность первого газа по второму, обозначаемая D. Следовательно, по условию задачи:
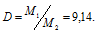
Мольная масса азота равна 28 г/моль. Тогда мольная масса паров серы равно:
M1 = D . M2 = 9,14 . 2 = 255,92 г/моль.
Зная, что Ar(S) = 32 г/моль, находим количество атомов (n), из которых состоит молекула серы:
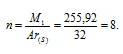
Таким образом, молекула серы состоит из одного атома.
Ответ: из восьми.
Задача 88.
Вычислить мольную массу ацетона, если масса 500 мл его паров при 87 °С и давлении 96 кПа (720мм рт. ст.) равна 0,93 г
Решение:
Выразив данные задачи в системе единиц СИ (Р = 9,6 . 104 Па; V = 5 . 10–4 м3; m = 0,93 . 10-3 кг; Т = 360 К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа:
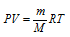
Здесь
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль.
Отсюда
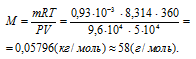
Ответ: 58 г/моль.
Задача 89.
При 17 °С и давлении 104 кПа (780мм рт. ст.) масса 624 мл газа равна 1,56 г. Вычислить молекулярную массу газа.
Решение:
Выразив данные задачи в системе единиц СИ (Р = 10,4 • 104 Па; V = 6,24 • 10-4 м3; m = 1,56 • 10-3 кг; Т = 290 К) и подставив их в уравнение Клапейрона- Менделеева (уравнение состояния идеального газа), находим мольную массу газа:
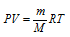
Здесь
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – температура газа, К; Р – давление газа, Па; V – объём газа, м3; М – мольная масса газа, г/моль.
Отсюда
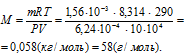
Ответ: 58 г/моль.

