Как правильно рассчитать объем исходного раствора аммиака
Задача 3.7.
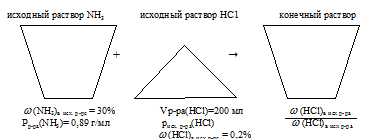
Какой объем 30%-ного раствора аммиака (р = 0,892 г/мл) необходимо добавить к 200 мл 40% -ного раствора соляной кислоты (р = 1,198 г/мл), чтобы массовая доля кислоты уменьшилась в 4 раза?
Дано:
массовая доля NН3 в исходном растворе:  (NН3)в исх. р-ре = 30% ;
(NН3)в исх. р-ре = 30% ;
плотность исходного раствора NН3: рр-ра(NН3) = 0,892 г/мл;
объем исходного раствора Нl1: Vр-ра(НСl) = 200 мл;
массовая доля НСl в исходном растворе соляной кислоты:  (НСl)в исх.р-ре = 40%;
(НСl)в исх.р-ре = 40%;
плотность исходного раствора НСl: рисх. p-ра(НСl) = 1,198 г/мл;
изменение массовой доли НСl в конечном растворе:  (НСl)в исх.р-ре = 40%;
(НСl)в исх.р-ре = 40%;
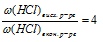
Найти: объем исходного раствора NН3: Vисх. р-ра(NН3) = ?
Решение:
Изобразим условие задачи в виде рисунка:
При сливании вместе двух исходных растворов между растворенными веществами происходит химическая реакция:
NН3 + НСl → NН4Сl.
Согласно условию задачи НСl из второго раствора расходуется не полностью и часть его остается в неизменном виде в конечном растворе. Массовая доля НСl в конечном растворе в 4 раза меньше, чем в исходном растворе, следовательно:
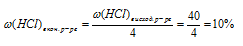
Схему решения можно представить следующим образом:
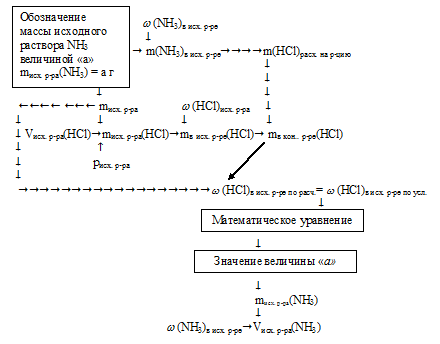
1. Несмотря на то, что в задаче требуется определить объем исходного раствора NН3, для упрощения промежуточных расчетов величиной «а» удобно обозначить его массу:
mисх. р-ра(NH3) = а г.
2. По значению плотности и объема находим массу исходного раствора НС1:
mисх. р-ра(НСl) =
= Vисх, р-ра(НСl) . рисх. р-ра(НСl) =
= 200 . 1,198 = 239,6 г.
3. Масса конечного раствора складывается из масс двух исходных растворов:
mкон. р-ра. =
= mисх. р-ра(НСl) + mисх. р-ра(NН3) =
= (239,6 + а) г.
4. Используя значение массовой доли NН3 в исходном растворе, определим массу NН3 в нем:
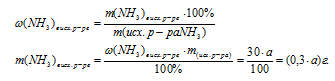
5. По уравнению реакции определим массу НСl, который расходовался при взаимодействии с NН3 массой (0,3 . а) г.
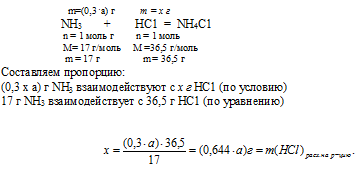
6. Находим массу НСl, который остался в конечном растворе после реакции:
m(НСl)в кон.р-ре =
= m(НСl)в исх. р-ре – m(НСl)расх. на р-цию
Массу НСl в исходном растворе находим, пользуясь значением массовой доли из условия и массой исходного раствора, полученного во втором действии.
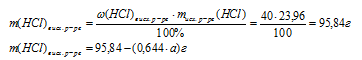
7. Используя значение массы НСl в конечном растворе (из 6 действия) и массу самого конечного раствора (из 3 действия) записываем выражение для массовой доли НСl в конечном растворе:
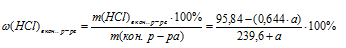
8. Приравниваем последнее выражение к значению массовой доли НСl, определенному в самом начале решения:
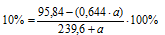
Получили математическое уравнение с одним неизвестным. Решая его, получаем:
а = 96,6.
Величиной «а» мы обозначали массу исходного раствора NН3:
mисх. р-ра(NH3) = 96,6 г.
9. Используя значение плотности исходного раствора NН3 из условия, определим его объем:
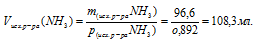
Ответ: Vисх. р-ра(NH3) = 108,3 мл.

