Как правильно рассчитать массу нитрида магния, подвергшегося разложению водой
Данная задача интересна тем, что на первом этапе происходит одна реакция, продукты которой участвуют в двух параллельных реакциях.
Задача 3.8.
Определите массу нитрида магния, полностью подвергшегося разложению водой, если для солеобразования с продуктами гидролиза потребовалось 300 мл 4%-ного раствора соляной кислоты (р = 1,02 г/мл).
Дано:
объем соляной кислоты: Vр-ра(НСl) = 300 мл;
массовая доля НС1 в соляной кислоте:  (НСl) = 4% ;
(НСl) = 4% ;
плотность соляной кислоты: рр-ра(НСl) = 1,02 г/мл.
Найти: массу Mg3N2.
Решение:
В условии задачи описано несколько последовательных химических реакций.
Мg3N2 + 6Н2O = ЗМg(ОН)2 + 2NH3 ( 1 ).
Оба продукта первой реакции будут взаимодействовать с соляной кислотой с образованием солей.
Мg(ОН)2 + 2НСl = МgСl2 + 2Н2О (2);
NH3 + НСl - NH4Сl (3).
Решение данной задачи необходимо вести с составлением математического уравнения. Схематично алгоритм можно представить таким образом:
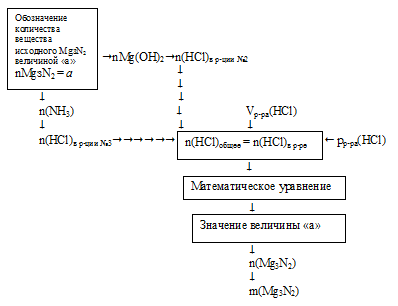
1. Обозначим количество вещества1 исходного Mg3N2 величиной «а»: n(Mg3N2) = а моль.
Используя величину «а» как известную, по первому химическому уравнению определяем количество вещества каждого из продуктов:
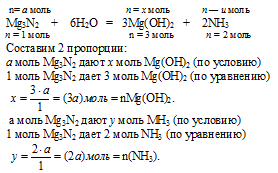
2. По второй химической реакции определяем количество вещества НСl, которое расходуется на солеобразование с (3а) моль Mg(OH)2.

3. По третьей химической реакции определяем количество вещества НСl, которое расходуется на солеобразование с (2а) моль МН3.

4. Определяем общее количество НС1, которое расходовалось в реакциях №2 и №3 по результатам расчета в предыдущих двух действиях.
n(HCl)общее =
= n(HCl)в р-ции№2 + n(НСl)в р-ции№3 =
= 6а + 2а = (8а) моль.
5. Определяем количество вещества НС1, которое содержалось в 300 мл 4%-ного раствора (по данным условия):
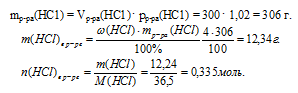
6. Составляем математическое уравнение. Для этого приравниваем количество вещества НС1, определенное путем расчета по химическим уравнениям (из 4 действия), и значение, найденное в 5 действии:
8а = 0,335.
Решая это математическое уравнение, находим значение величины «а»:
а = 0,042 моль.
Величиной «а», мы обозначали количество вещества исходного Мg3N2: n(Мg3N2) = 0,042 моль.
7. Определяем массу исходного вещества:
m(Мg3N2) = n(Мg3N2) . M(Мg3N2) =
= 0,042 . 100 = 4,2 г.
Ответ: m(Мg3N2) = 4,2 г.
Комментарии:
1Величиной «а» можно было обозначить и массу исходного вещества. В этом случае в расчетах фигурировали бы более сложные значения, и возросла вероятность арифметической ошибки.

