Расчет массовой доли уксусной кислоты в смеси с муравьиной
В данной задаче идут две параллельные реакции с участием смеси веществ.
Задача 3.9.
На нейтрализацию 7,6 г смеси муравьиной и уксусной кислот израсходовано 35 мл 20% -ного раствора гидроксида калия (р = 1,2 г/мл). Рассчитайте массу уксусной кислоты и ее массовую долю в исходной смеси кислот.
Дано:
масса смеси кислот: m(смеси кислот) = 7,6 г;
объем раствора КОН: Vр-ра(КОН) = 35 мл;
массовая доля КОН в исходном р-ре:  (КОН)в исх. р-ре = 20% ;
(КОН)в исх. р-ре = 20% ;
плотность исходного раствора КОН: рисх. р-ра(КОН) = 1,2 г/мл.
Найти: массу уксусной кислоты: m(СН3СООН);
массовую долю СН3СООН в исходной смеси:  (СН3СООН) = ?
(СН3СООН) = ?
Решение:
При взаимодействии смеси кислот с гидроксидом калия одновременно идут две реакции:
СН3СООН + КОН → СН3СООК + Н2О;
НСООН + КОН → НСООК + Н2О.
Решение задачи возможно по встречному алгоритму с составлением математического уравнения. Схему решения можно представить следующим образом:
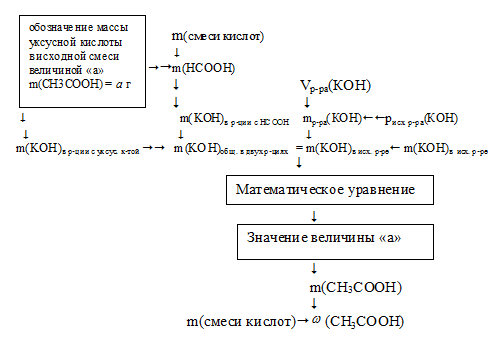
1. Обозначим массу уксусной кислоты в исходной смеси величиной «а»:
m(СН3СООН) = а г.
Тогда массу муравьиной кислоты можно определить по разности:
m(НСООН) =
= m(смеси кислот) – m(СН3СООН) =
= (7,6 - а) г.
2. По уравнению реакции уксусной кислоты с раствором щелочи определим массу КОН, который расходовался в этом взаимодействии.

3. Аналогично по уравнению реакции с муравьиной кислотой находим массу КОН, который расходовался во втором взаимодействии.

4. Находим общую массу КОН, который расходовался в двух реакциях:
m(КОН) =
= m(КОН)в р-ции с укс к-той + m(КОН)в р-ции с мур к-той =
= 0,933 . а + (9,25 – 1,217 . а) = (9,25 – 0,284 . а) г.
5. Находим массу КОН, который содержался в 200 мл исходного раствора:
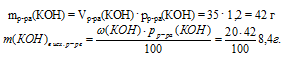
6. Приравниваем выражение, полученное в 4 действии к значению массы КОН из 5 действия:
9,25 – 0,284 . а = 8,4.
Получили математическое уравнение. Решая его, находим значение величины «а»:
а = 3.
Величиной «а» мы обозначали массу уксусной кислоты:
m(СН3СООН) = 3 г.
7. Находим массовую долю СН3СООН в исходной смеси кислот
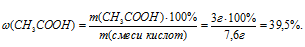
Ответ: m(CH3COOH) = 3 г;  (CH3COOH) = 39,5%.
(CH3COOH) = 39,5%.

