Определение массы аммиака и объема газообразного продукта при окислении его перманганатом калия
Данная задача интересна по двум причинам: во первых, наличием примеси в одном из веществ; во вторых, неоднозначностью описанных в условии реакций.
Задача 3.10.
Для окисления некоторого количества аммиака потребовался такой объем кислорода (н.у.), который образуется при разложении 245,6 г перманганата калия, содержащего 3,5% бескислородной примеси. Определите массу аммиака, вступившего в реакцию, и объем образовавшегося азотсодержащего продукта окисления (н.у.).
Дано:
масса перманганата калия с примесями: m(КМnО4 + примеси) = 245,6 г;
массовая доля примесей в КМnО4:  (примесей) = 3,5% .
(примесей) = 3,5% .
Найти: массу аммиака: m(NH3);
объем азотсодержащего продукта реакции (н.у.): V(прод.) = ?
Решение:
В условии задачи описаны две последовательные реакции:
Разложение перманганата калия:
2КМnО4 = К2МnО4 + МпО2↓ + О2↑
Окисление аммиака кислородом, полученным в первой реакции. Но процесс окисления может идти по-разному. При горении (частный случай реакции окисления) образуются азот и вода:
4NН3 + 3O2 = 2N2 + 6Н2О.
При окислении в присутствии катализатора сначала1 образуется оксид азота (II) и вода:
4NН3 + 5O2 = 4NO + 6Н2О.
При расчете по каждому из последних двух уравнений получаются разные ответы. Указание в условии на азотсодержащий продукт окисления (а не горения) наводит на мысль об образовании NО. Но в инструкции для проверяющих тесты ЕГЭ весь расчет проведен с учетом получения азота. В ситуации решения данной задачи на экзамене можно было использовать любую из предложенных здесь реакций окисления и в случае незаслуженно низких баллов, доказывать свою правоту на апелляции. Но есть и альтернативный, более разумный вариант поведения. Привести в решении расчеты по каждому из возможных вариантов. Один из них однозначно совпадет с вариантом правильного ответа у проверяющих, и высший балл за это задание Вам гарантирован. Здесь мы приведем вариант решения в предположении горения аммиака.
Алгоритм можно представить следующей схемой:
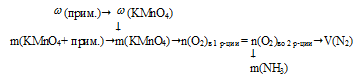
1. Определяем массу чистого КМnО4:
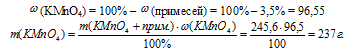
2. По первому уравнению реакции определяем количество вещества образовавшегося кислорода:
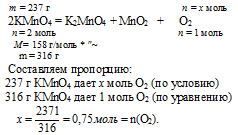
3. Так как весь кислород, выделившейся в 1 реакции, пошел на реакцию горения аммиака, мы можем вычислить объем образовавшегося азота и массу сгоревшего аммиака.

Ответ: m(NH3) = 17 г; V(N2) = 11,2 л.
Комментарии:
1При избытке кислорода оксид азота(II) легко окисляется до оксида азота(IV).

