Методы определения массовых долей веществ в смеси двух солей
Задача 3.14.
Газ, полученный при сжигании 6,4 г серы, без остатка прореагировал с 138 мл 8% раствора NаОН (р = 1,087 г/мл). Определите состав полученного раствора и рассчитайте массовые доли веществ в этом растворе.
Дано:
масса серы: m(S) = 6,4 г;
объем исходного р-ра гидроксида натрия: Vр-ра(NаОН)=138 мл;
массовая доля NаОН в исходном р-ре:  (NаОН)в исх р-ре = 8%
(NаОН)в исх р-ре = 8%
плотность исходного раствора NаОН: рр-ра(NаОН) = 1,087 г/мл.
Найти: состав полученного раствора;
массовую долю каждого вещества в конечном растворе.
Решение:
Для определения количеств каждой из солей в конечном растворе можно использовать несколько алгоритмов.
I способ (математический с составлением простой системы уравнений).
В условии описано несколько последовательных реакций. При сжигании серы получается сернистый газ1:
S + О2 = SО2
Далее SО2 пропускают через раствор NаОН, где может образоваться как средняя, так и кислая соли:
2NаОН + SО2 = Nа2SО3 + Н2О;
NаОН + SО2 = NаНSО3
Кроме того, при значительном избытке SО2 может идти реакция с образованием сернистой кислоты:
SО2 + Н2О = Н2SО3
В зависимости от соотношения количеств веществ NаОН и SО2 может реализоваться одна из следующих ситуаций:
а) при большом избытке SО2 [n(NаОН) : n(SО2) < 1 : 1] весь гидроксид натрия расходуется на образование кислой соли, а оставшийся в избытке SО2 взаимодействует с водой с образованием Н2SО3;
б) при соотношении [n(NаОН) : n(SО2) = 1 : 1] образуется только кислая соль;
в) при соотношении [n(NаОН) : n(SО2) = 2 : 1] образуется только средняя соль;
г) при значительном избытке гидроксида натрия
[n(NаОН) : n(SО2) > 2 : 1] образуется только средняя соль и часть NaОН останется в растворе в неизменном виде;
д) когда соотношение количеств веществ и гидроксида натрия и сернистого газа находится в промежутке:
[2 : 1 > n(NаОН) : n(SО2) > 1 : 1],
образуется и кислая, и средняя соль. Причем соотношение количеств получающихся солей зависит от соотношения количеств NаОН и SО2. Чем больше будет МаОН (в пределах указанного интервала), тем больше будет доля средней соли в образующейся смеси.
Для определения, какие именно продукты и в каких количествах образуются в конечном растворе, необходимо найти исходные количества веществ SО2 и NаОН.
1. Количество вещества сернистого газа определим по уравнению сгорания серы:
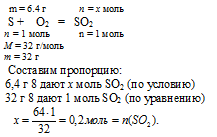
2. Количество вещества гидроксида натрия находим по данным об исходном растворе NaOH:
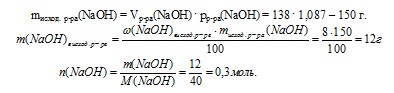
3. Сопоставим количества вещества NаОН и SО2 и определим, какие вещества будут содержаться в конечном растворе.
2 : 1 > n(NаОН) : n(SО2) = 0,3 : 0,2 > 1 : 1
Следовательно, в конечном растворе будет смесь солей: Nа2SО3 и NаНSО3. Реализуется случай «5» из описанных выше.
Алгоритм дальнейших действий схематично можно изобразить следующим образом:
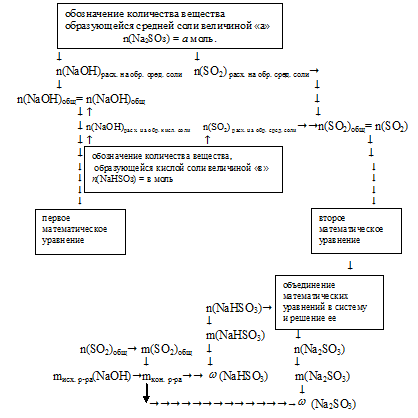
4. Обозначим количество вещества образующейся средней соли величиной «а»:
n(Na2SO3)= а моль.
5. По уравнению реакции получения средней соли находим количества вещества NаОН и SО2, которые расходуются на образование Nа2SО3

6. Обозначим количество вещества образующейся кислой соли величиной «в»:
n(NаНSО3) = в моль.
7. По уравнению реакции получения кислой соли находим количества веществ NаОН и SO2, которые расходовались на образование NаНSО3

8. По результатам 5 и 7 действий находим общее количество вещества NаОН, расходовавшегося в двух реакциях:
n(NаОН)общ =
= n(NаОН)расход. на обр. сред. соли + n(NаОН) расход. на обр. кисл. соли =
= [(2 . a) + в] моль.
Приравниваем полученное выражение к значению количества вещества NаОН, которое содержалось в исходном растворе (из 2 действия):
2 . a + в = 0,3 моль.
Получили первое математическое уравнение с двумя неизвестными.
9. По результатам 5 и 7 действий находим общее количество вещества SО2, расходовавшееся в двух реакциях:
n(SO2)общ =
= n(SO2)расход. на обр. сред. соли + n(SO2) расход. на обр. кисл. соли =
= (a + в) моль.
Приравниваем полученное выражение к значению количества вещества SО2, полученному при сжигании серы (в 1 действии):
а + в = 0,2.
Получили второе математическое уравнение с двумя неизвестными.
10. Объединяем математические уравнения из 8 и 9 действий в систему:
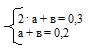
Решая эту систему, находим значения:
а = 0,1; в = 0,1.
Величинами «а» и «в» мы обозначали количества вещества средней и кислой соли:
n(Nа2SО3) = 0,1 моль; n(NаНSО3) = 0,1 моль.
11. Теперь определяем массовую долю каждой соли в конечном растворе. Для этого находим массу каждой соли и массу конечного раствора, которая складывается из суммы масс SО2 и исходного раствора NаОН:
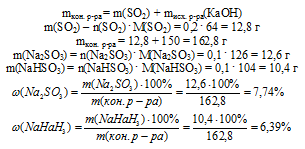
Ответ:  (Nа2SО3) = 7,74%;
(Nа2SО3) = 7,74%;  (NаНSО3) = 6,39%.
(NаНSО3) = 6,39%.
Есть и иной способ определения количества каждой из солей в конечном растворе.
II способ (последовательный)
Этот способ основан на предположении, что последовательно могут идти 4 химические реакции:
1. При сжигании серы образуется сернистый газ:
S + О2 = SО2
2. Полученный SО2 взаимодействует с гидроксидом натрия с образованием средней соли:
SО2 + 2NaOH = Nа2SО3 + Н2О
3. При избыточном количестве SО2, когда весь NaОН заканчивается, может идти следующая реакция:
SO2 + Н2O + Nа2SО3 = 2NаНSО3
4. Если SО2 взят в избытке даже по отношению к реакции образования кислой соли, возможно получение сернистой кислоты:
SО2 + Н2О = Н2SО3
Схематично алгоритм решения по этому способу будет носить альтернативный характер. Графически его можно изобразить так:
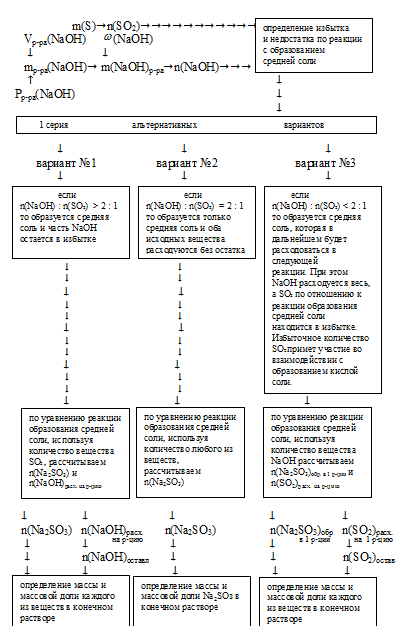
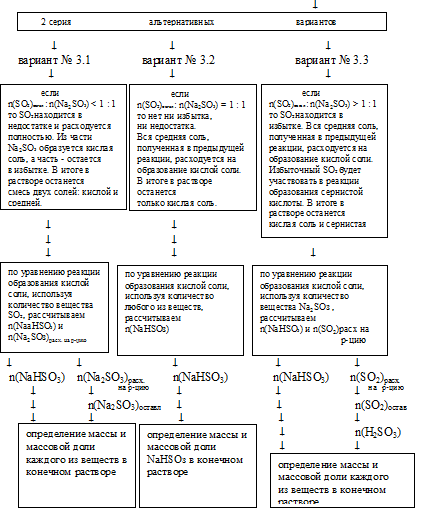
При решении данной задачи в первой серии альтернативных вариантов реализуется случай № 3, и это приводит ко второй серии альтернативных вариантов, из которых реализуется случай № 3.1. Приведем решение данной задачи по этому способу:
1. Определение количеств веществ NаОН и SО2 проводим точно также, как и в предыдущем способе. В результате получаем:
n(NаОН) = 0,3 моль; n(SО2) = 0,2 моль.
2. Определяем, какое вещество находится в недостатке для реакции образования средней соли.
Выберем за основу гидроксид натрия и определим по уравнению реакции количество SО2, которое необходимо для расходования 0,3 моль NаОН:

| n(SO2) необходимо | n(SO2) дано по условию |
| 0,15моль < 0,2 моль | |
SО2 находится в избытке и расходуется не весь на образование средней соли. Поэтому дальнейшие расчеты по этому уравнению реакции будем проводить по NаОН, так как он в
недостатке и расходуется весь. Реализуется третий вариант из первой серии:
[n(NаОН) : n(SО2) < 2 : 1]
3. По уравнению реакции образования средней соли, используя количество вещества NаОН, рассчитываем количество вещества средней соли, образующейся в данной реакции, и количество вещества расходующегося сернистого газа:
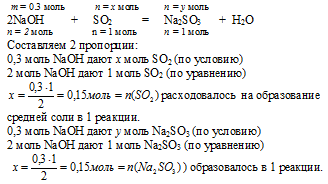
4. Находим количество вещества избыточного SО2, который остался после 1 реакции образования средней соли:
n(SО2)осталось =
= n(SО2)было – n(SО2)расх. на р-цию =
= 0,2 – 0,15 = 0,05 моль.
5. Определяем, какое вещество находится в недостатке для реакции образования кислой соли.
Выберем за основу сульфит натрия и определим по уравнению реакции количество SO2, которое необходимо для расходования 0,1 моль Nа2SO3
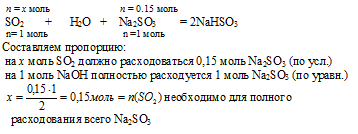
| n(SO2) необходимо | n(SO2) дано по условию |
| 0,15моль > 0,05 моль | |
SO2 находится в недостатке и расходуется весь в процессе данной реакции. Поэтому дальнейшие расчеты по этому уравнению реакции будем проводить по SО2. Реализуется первый вариант из второй серии:
[n(SO2)остал: n(Nа2SО3) < 1 : 1].
6. По уравнению реакции образования кислой соли, используя количество вещества SО2, рассчитываем количество вещества образующейся кислой соли и количество вещества расходующейся средней соли.

7. Находим количество вещества Nа2SO3, которое осталось после образования кислой соли:
n(Nа2SО3)осгалось – n(Nа2SO3)обр. в 1 р-ции –
= n(Nа2SО3)расх. во 2 р-ции =
= 0,15 – 0,05 = 0,1 моль.
8. Итак, в конечном растворе будут присутствовать 2 соли:
n(Nа2SО3) – 0,1 моль и n(NaHSО3) = 0,1 моль.
Дальнейший расчет их массовых долей в конечном растворе проводим так же, как и в первом способе решения.
Ответ:  (Nа2SО3) = 7,74% ;
(Nа2SО3) = 7,74% ;  (NaHSО3) = 6,39%.
(NaHSО3) = 6,39%.
Первый из рассмотренных способов решения данной задачи выглядит более формализованным и математизированным. Но .к его достоинствам можно отнести краткость (относительно второго способа) и возможность применения для более сложных задач, когда существует возможность образования большего количества альтернативных продуктов, например как в задаче по взаимодействию NаОН и Н3РО4.
К достоинствам второго способа можно отнести его большую логичность и последовательность, но применение его к более сложным системам приведет к огромному количеству расчетов.
Здесь же хотелось бы отметить, что задачи с использованием смеси веществ (либо исходных, либо продуктов) в тестах ЕГЭ являются наиболее сложными.
Задачи на определение массовой доли вещества:
1. Определение массовой доли соли
2. Определение массовой доли глюкозы
3. Определение массовой доли кислоты
Kомментарии:
1 Возможностью образования SO3 мы пренебрегаем.

