Выявление количественного состава вещества при некоторой неопределенности в элементном составе
Задача 147.
При полном сгорании 22 г некоторого органического соединения образовалось 25,49 л (н.у.) углекислого газа (СО2) и 20,48 г воды (Н2О). Определите молекулярную формулу сгоревшего соединения, если известно, что относительная плотность его паров по метану составляет 3,625.
Дано:
масса органического соединения: mорг в-ва = 22 г;
объем углекислого газа (н.у.): V = 25,49 л;
масса воды: m(Н2О) = 20,48 г;
относительная плотность паров исходного вещества по метану: D(СН4) = 3,625.
Найти:
молекулярную формулу сгоревшего соединения.
Решение:
Шаг 1. Класс органического соединения не указан, поэтому об элементарном составе можно судить только по продуктам реакции. Углерод и водород входили в состав сгоревшего вещества однозначно, так как эти элементы присутствуют в продуктах горения, а из воздуха принимал участие в реакции только кислород. Причем весь углерод и весь водород полностью перешли из исходного вещества в СО2 и Н2О. Возможно, в состав искомого соединения также входил кислород. Прояснить ситуацию с наличием или отсутствием кислорода можно по данным из условия задачи. Нам известна масса сгоревшего органического соединения и количественные данные, относящиеся к продуктам. Очевидно, что если суммарная масса углерода из СО2 и водорода из Н2О окажется равной массе исходного органического вещества, то кислорода в его составе не было. В ином случае:
m(С)(в СО2) + m(Н)(в Н2О) < mорг в-ва
ислород входил в состав исходного вещества, причем его масса определится по разности:
mорг. в-ва – m(C)(СО2) – m(Н)(в Н2О) = m(О)(в исх. в-ве)
Осуществим необходимые расчеты. Найдем массу углерода в СО2 по алгоритму:
V(СО2) →n(СО2) → n(С)(в СО2) → m(С)(в СО2)
a)V(CO2) → n(CO2)
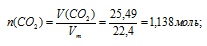
б) n(CO2) → n(С)(в CO2)
n(С)(в CO2) = n(CO2) = 1,138 моль (по индексам в формуле).
в) n(С)(в CO2) = m(С)(в CO2)
m(С)(в CO2) = n(С)(в CO2) . M(С) = 1,138 . 12 = 13,66 г = m(C)(в исх. в-ве).
Найдем массу водорода в 20,48 г воды.
М(Н2О) = 2 . 1 + 1 . 16 =18 г/моль.
18 г — масса 1 моль воды, и в этой массе содержится 2 г водорода.
Составим пропорцию:
18 г Н2О содержит 2 г водорода
20,48 г Н2О содержит х г водорода
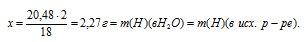
Сравниваем суммарную массу углерода и водорода с массой исходного вещества
m(С)(в CO2) + m(Н)(в Н2O) = 13,66 + 2,27 = 15,93 г;
mорг. в-ва = 22 г;
m(С)(в CO2) + m(Н)(в Н2O) < mорг. в-ва.
следовательно, кислород входит в состав исходного вещества
m(О)(в исх. в-ве) =
= mорг. в-ва – m(С)(в СО2) – m(Н)(в Н2О) =
= 22 – 15, 93 = 6, 07 г.
Итак, в 22,0 г исходного вещества содержится: углерод, водород и кислород.
Дальнейшие действия ничем не отличатся от примеров ранее рассмотренных задач.
Обозначим искомое вещество как СхНуОz.
Шаг 2. Составим схему реакции горения:
СхНуОz + O2 → CO2 + H2O.
Шаг 3. Определим соотношения количеств вещества (n) углерода, водорода и кислорода в исходном образце органического вещества. Количество вещества углерода мы уже определили в первом шаге:
n(С)(в исх. в-ве) = n(С)(в СО2) = 1,138 моль.
Количества вещества (п) водорода и кислорода найдем по данным о массах этих элементов, полученным в 1 шаге.
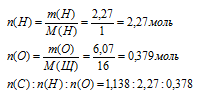
Шаг 4. Находим простейшую формулу.
N (С) : N(Н) : N(О) = 1,138 : 2,27 : 0,379
Выбираем наименьшее значение (в данном случае 0,379) и делим на него все три числа:
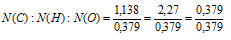
Получили набор наименьших целых чисел:
N (С) : N(Н) : N(О) = 3 : 6 : 1
Это дает возможность записать простейшую формулу: С3H6О1.
Шаг 5. Выявление истинной формулы вещества.
По данным об относительной плотности паров искомого вещества по метану определяем истинную молярную массу. Воспользуемся соотношением:
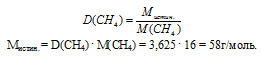
Определим значение молярной массы для простейшей формулы:
Мпрост = (3 . 12) + (6 . 1) + (1 . 16) = 58 г/моль.
Мпрост.= Мистин., следовательно, простейшая формула является истинной: С3Н6О.
Ответ: С3Н6О.
Задачи на вывод формулы вещества:
1. Вывод формулы органического вещества
2. Вывод формулы кристаллогидрата

