Решение задач на газовые смеси (закон Авогадро)
Задача 71.
При прохождении смеси равных объемов SO2 и О2 через контактный аппарат 90% молекул SO2 превращается в SO3. Определить состав (в процентах по объему) газовой смеси, выходящей из контактного аппарата.
Решение:
Уравнение реакции горения сернистого газа имеет вид:
2SO2 + O2 = 2SO3 .
Из уравнения реакции вытекает, что из двух молекул SO2 и одной молекулы O2 образуются две молекулы SO3. Известно, что из каждого литра SO2 превратилось в SO3 0,9 л, при этом образовалось тоже 0,9 л SO3. Кислорода на каждый литр прореагировало соответственно 0,45 л О2 (0,9/2 = 0,45).
Таким образом, выходящая смесь газов из контактного аппарата, на каждый литр смеси состояла из 0,1 л SO2 (1 – 0,9 = 0,1) и 0,55 л О2 (1 – 0,45 = 0,55). Общий объём смеси, выходящей из контактного аппарата, составляет 1,55 л (0,1 + 0,55 + 0,9 = 1,55).
Задача 72.
Смесь, состоящая из трех объемов Сl2 и одного объема H2, оставлена в закрытом сосуде на рассеянном свету при постоянной температуре. Через некоторое время содержание Сl2 в смеси уменьшилось на 20%. Изменилось ли давление в сосуде? Каков процентный состав смеси по объему?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
Cl2 + H2 = 2HCl
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т. е. реакция идёт без изменения объёма. При нормальных условиях из трёх литров хлора в реакцию вступило 0,6 л (3 . 0,2 = 0,6). Точно такое же количество водорода тоже вступило в реакцию. Таким образом, при взаимодействии 0,6 л хлора и 0,6 л водорода образовалось 1,2 л хлороводорода (2 . 3 = 0,6). Так как реакция идёт без изменения объёма, то давление в системе тоже не изменится.
Находим процентный состав газовой смеси по формуле:

Ответ: не изменилось; (Cl2) = 60%;
(Cl2) = 60%; (HCl) = 40%.
(HCl) = 40%.
Задача 73.
При взаимодействии NН3 с Сl2 образуются хлороводород и азот. В каких объемных соотношениях взаимодействуют NH3 и С12 и каково отношение объемов получающихся газов?
Решение:
Уравнение реакции взаимодействия аммиака с хлором имеет вид:
2NH3 + 3Cl2 = 6HCl + N2
При взаимодействии аммиака с хлором из каждых двух объёмов аммиака и трёх объёмов хлора образуются шесть объёмов хлороводорода и один объём азота. Таким образом, аммиак и хлор взаимодействуют в объёмных отношениях 2 : 3 (2VNH3 : 3VCl), а отношение объёмов получающихся газов – 1 : 6 V(N2 : V(HCl).
Ответ: V(NH3) : V(Cl2) = 2 : 3; V(HCl) : V(N2) = 6 : 1.
Задача 74. Какой объем Н2 (при 17 °С и давлении 102,4 кПа) выделится при растворении 1,5 кг цинка в соляной кислоте?
Решение:
Уравнение реакции имеет вид:
Zn + 2HCl = ZnCl2 + H2↑
Зная мольную массу цинка (65,4 г/моль) и мольный объём газа (22,4 л), находим объём водорода, который выделится при растворении 1,5кг цинка из пропорции:
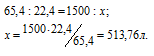
Затем приводим полученный объём к указанным условиям используя объединённое уравнение закона Бойля- Мариотта и Гей-Люссака, находим V0:
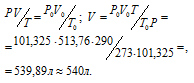
где
P и V - давление и объём газа при температуре T = 290К (273 +17 = 290); P0 = 101,325 кПа; T0 = 273 К; P = 102,4 кПа; V0 -объём газа (н.у.) = 513,76 л.
Ответ: 540 л.
Задача 75.
После взрыва смеси, состоящей из одного объема исследуемого газа и одного объема Н2, получился один объем водяного пара и один объем азота. Все измерения производились при одинаковых условиях. Найти формулу исследуемого газа.
Решение:
Молекулярная формула воды H2O, а азота – N2. Так как продукты реакции и исходные вещества состоят из одинаковых объёмов, то, учитывая, что образуются по одной молекуле воды и азота из одной молекулы водорода и одной молекулы исследуемого газа, можно предположить, что молекула исследуемого газа состоит из двух атомов азота и одного атома кислорода. Следовательно, формула исследуемого газа имеет вид N2O.
Ответ: N2O.
Задача 76
При одинаковых условиях взяты равные объемы N2 и O2. Каково соотношение масс обоих газов:
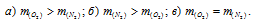
Решение:
Согласно закону Авогадро, в равных объёмах любых газов, взятых при одинаковых условиях (одной и той же температуре и одинаковом давлении) содержится одинаковое число молекул (6,02 . 1023). Поскольку M(O2) равен 32 г/моль, а M(N2) – 28г/моль, то m(O2) > m(N2)
Ответ: а).
Задача 77.
Смешали равные объемы Н2 и С12. Как изменится объем смеси после протекания реакции: а) не изменится;
б) увеличится в два раза; в) уменьшится в два раза?
Решение:
Уравнение реакции взаимодействия хлора с водородом имеет вид:
Cl2 + H2 = 2HCl
При взаимодействии одного моля хлора с одним моль водорода образуется два объёма хлороводорода, т.е. реакция идёт без изменения объёма. Поэтому объём смеси после протекания реакции не изменится.
Ответ: а).
Задача 78.
Каково соотношение объемов, занимаемых 1 моль НСI и 1 моль Сl2 (Т и Р одинаковы):
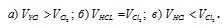
Решение:
Согласно закону Авогадро одно и тоже число молекул любого газа занимает при одинаковых условиях (температура и давление одинаковы) один и тот же объём. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объём. Этот объём называется мольным объёмом газа и при нормальных условиях (Т = 0 °С и Р = 101,325 кПа) равен 22,4 л. Поэтому соотношение объёмов одного моля HCl и одного моля Cl2 (T и Р одинаковы):
V(HCl) = V(Cl2).
Ответ: б).
Задача 79.
При нагревании НВг полностью разлагается. При этом объём газа не изменяется. Каковы продукты реакции разложения: а) атомы Н и Вг; б) молекулы Н2 и Вг2 в) молекулы Н2 и атомы Br?
Решение:
Уравнение реакции термического разложения бромоводорода имеет вид:
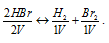
Таким образом, из двух молекул НВг образуются одна молекула Н2 и одна молекула Вг2, т.е. объём системы после реакции не изменяется. Следовательно, продуктами реакции термического разложения HBr являются газообразные Н2 и Вг2.
Ответ: б).

