Уравнения реакций, характеризующих свойства галогенов
Задача 831.
Закончить уравнения реакций:
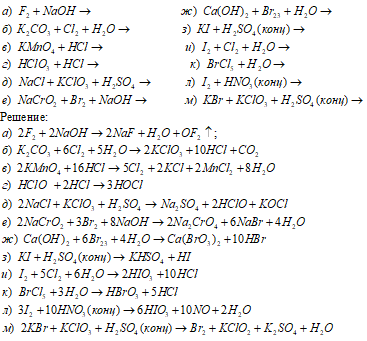
Задача 832.
Какие из перечисленных реакций могут быть осуществлены с целью получения кислородных соединений галогенов?
а) Cl2 + 2O2 = 2ClO2;
б) F2 + 1/2O2 = F2O;
в) 3Cl2 + 10HNO3 = 6HClO3 + 10NO + 2H2О;
г) 3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O.
Решение:
Уравнение реакция имеет вид:
Cl2 + 2O2 = 2ClO2.
По табличным данным находим:
 H0 = 2 . 105 кДж/моль;
H0 = 2 . 105 кДж/моль;
 G0 = 2 . 122,3 кДж/моль.
G0 = 2 . 122,3 кДж/моль.
При  G0 > 0 реакция в обычных условиях самопроизвольно не протекает. Учитывая, что реакция протекает с уменьшением количества газообразных веществ, т.е. система стремится к упорядочению,
G0 > 0 реакция в обычных условиях самопроизвольно не протекает. Учитывая, что реакция протекает с уменьшением количества газообразных веществ, т.е. система стремится к упорядочению,  S0 < 0. Исходя из уравнения:
S0 < 0. Исходя из уравнения:
 G =
G =  H - T
H - T S.
S.
При положительном значении  H и отрицательном значении
H и отрицательном значении  S, если даже повышать температуру, то член равенства (T
S, если даже повышать температуру, то член равенства (T S) всё равно будет иметь положительное значение [-T . -T
S) всё равно будет иметь положительное значение [-T . -T S = T
S = T S], что указывает на то, что
S], что указывает на то, что  G всегда будет иметь положительное значение, а при
G всегда будет иметь положительное значение, а при  G > 0 процесс не протекает самопроизвольно. Таким образом, данная реакция не может быть использована для получения ClO2.
G > 0 процесс не протекает самопроизвольно. Таким образом, данная реакция не может быть использована для получения ClO2.
б) Уравнение реакция имеет вид:
F2 + 1/2O2 = F2O.
По табличным данным находим:
 H0 = 50,2 кДж/моль;
H0 = 50,2 кДж/моль;  G_0 = 50,2 кДж/моль.
G_0 = 50,2 кДж/моль.
При  G0 > 0 реакция в обычных условиях самопроизвольно не протекает. Учитывая, что реакция протекает с уменьшением количества газообразных веществ, т.е. система стремится к упорядочению,
G0 > 0 реакция в обычных условиях самопроизвольно не протекает. Учитывая, что реакция протекает с уменьшением количества газообразных веществ, т.е. система стремится к упорядочению,  S0 < 0. Исходя из уравнения:
S0 < 0. Исходя из уравнения:
 G =
G =  H - T
H - T S
S
При положительном значении  H и отрицательном значении
H и отрицательном значении  S, если даже повышать температуру, то член равенства (T
S, если даже повышать температуру, то член равенства (T S) всё равно будет иметь положительное значение [-T . -T
S) всё равно будет иметь положительное значение [-T . -T S = T
S = T S], что указывает на то, что
S], что указывает на то, что  G всегда будет иметь положительное значение, а при
G всегда будет иметь положительное значение, а при  G > 0 процесс не протекает самопроизвольно. Таким образом, данная реакция не может быть использована для получения OF2.
G > 0 процесс не протекает самопроизвольно. Таким образом, данная реакция не может быть использована для получения OF2.
в) Уравнение реакция имеет вид:
3Cl2 + 10HNO3 = 6HClO3 + 10NO + 2H2О.
 G0 (NO) = 80,6 кДж/моль;
G0 (NO) = 80,6 кДж/моль;
 G0 (HNO3) = -80,9 кДж/моль;
G0 (HNO3) = -80,9 кДж/моль;
 G0 (H2O) = -237,4 кДж/моль;
G0 (H2O) = -237,4 кДж/моль;
 G0 (ClO3-) = -0,2 кДж/моль.
G0 (ClO3-) = -0,2 кДж/моль.
Рассчитаем  G_0 реакции:
G_0 реакции:
 G0 = [6
G0 = [6 G0 (HClO3) + 10
G0 (HClO3) + 10 G0 (NO) +
G0 (NO) +
+  G0 (H2O)] - 10
G0 (H2O)] - 10 G (HNO3) =
G (HNO3) =
= 6(-0,2) + 10(80,6) + 2(-237,4) -
- 10(-80,9) = 1139,0 кДж.
При  G0 > 0 реакция в обычных условиях самопроизвольно не протекает. Учитывая, что реакция протекает с увеличение количества газообразных веществ, т.е. система стремится к беспорядку,
G0 > 0 реакция в обычных условиях самопроизвольно не протекает. Учитывая, что реакция протекает с увеличение количества газообразных веществ, т.е. система стремится к беспорядку,  S0 < 0. Исходя из уравнения:
S0 < 0. Исходя из уравнения:
 G =
G =  H - T
H - T S.
S.
При положительном значении  H0 и положительном значении
H0 и положительном значении  S0, член равенства (T
S0, член равенства (T S) будет иметь отрицательное значение [-T . -
S) будет иметь отрицательное значение [-T . - S = T
S = T S] только при очень высоких температурах
S] только при очень высоких температурах  G реакции будет иметь отрицательное значение. Таким образом, данная реакция не может быть использована для получения хлорной кислоты.
G реакции будет иметь отрицательное значение. Таким образом, данная реакция не может быть использована для получения хлорной кислоты.
г) Уравнение реакция имеет вид:
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O.
 G0 (NO) = 80,6 кДж/моль;
G0 (NO) = 80,6 кДж/моль;
 G0 (HNO3) = -80,9 кДж/моль;
G0 (HNO3) = -80,9 кДж/моль;
 G0 (H2O) = -237,4 кДж/моль;
G0 (H2O) = -237,4 кДж/моль;
 G0 (IO3-) = -230,1 кДж/моль.
G0 (IO3-) = -230,1 кДж/моль.
Рассчитаем  G_0 реакции:
G_0 реакции:
 G0 = [6
G0 = [6 G0(HIO3) + 10
G0(HIO3) + 10 G0 (NO) +
G0 (NO) +
+ G0(H2O)] - 10
G0(H2O)] - 10 G0(HNO3) =
G0(HNO3) =
= 6(-230,1) + 10(80,6) + 2(-237,4) -
- 10(-80,9) = -240,4 кДж.
Так как  G_0 < 0, то реакция при обычных условиях может самопроизвольно протекать, учитывая, что реакция протекает с увеличением количества газообразных веществ, т.е система стремится к беспорядку,
G_0 < 0, то реакция при обычных условиях может самопроизвольно протекать, учитывая, что реакция протекает с увеличением количества газообразных веществ, т.е система стремится к беспорядку,  S_0 > 0. Исходя из уравнения:
S_0 > 0. Исходя из уравнения:
 G =
G =  H - T
H - T S.
S.
При отрицательном значении  H и положительном значении
H и положительном значении  S, член равенства (T
S, член равенства (T S) будет иметь отрицательное значение [-T .
S) будет иметь отрицательное значение [-T .  S = -T
S = -T S] при любых значениях температуры
S] при любых значениях температуры  G0 реакции будет иметь отрицательное значение. Допустим, что
G0 реакции будет иметь отрицательное значение. Допустим, что  G0 > 0, то при достаточно большой температуре
G0 > 0, то при достаточно большой температуре  G0 реакции тоже будет иметь отрицательное значение. Значит, данная реакция может быть использована для получения HIO3.
G0 реакции тоже будет иметь отрицательное значение. Значит, данная реакция может быть использована для получения HIO3.
Ответ: г).
Задача 833.
С какими из перечисленных веществ взаимодействует НВг: а) Са(ОН)2; б) РСI3; в) H2SO4 (конц.); г) КI; д) Мg; е) КСIО3? При этом НВг проявляет свойства: 1) кислоты; 2) основания; З) окислителя; 4) восстановителя.
Решение:
Взаимодействие бромоводорода со следующими веществами:
а) Ca(OH)2 + HBr ↔ CaBr2 + 2H2O.
HBr – кислота, которая со щелочами вступает в реакцию нейтрализации.
б) Трихлористый фосфор представляет собой хлористый ангидрид фосфористой кислоты, поэтому в реакцию с HBr как с кислотой не вступает.
в) В HBr атом брома находится в своей низшей степени окисления, поэтому с сильными окислителями, такими как H2SO4 он будет играть роль восстановителя.
Электронные уравнения реакции:
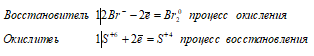
2Br- + S+6 ↔ Br20 + S+4.
2НBr + H2SO4 ↔ Br2 + SO2↑ + 2H2O.
г) Иодид калия и бромид водорода являются сильными электролитами и в водных растворах полностью диссоциируют на ионы:
KI ↔ K+ + I-;
HBr ↔ H+ + Br-
Связывание ионов не происходит, поэтому реакция не протекает, так как не образуется ни осадка, ни газа, ни малодиссоциируемого вещества (слабого электролита)
д) Магний – металл, стоящий в ряду напряжений металлов до водорода, поэтому из растворов кислот будет вытеснять водород из бромоводорода, При этом магний будет яаляться восстановителем, а бромоводород – окислителем:
Электронные уравнения процессов:
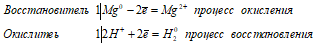
Mg0 + 2H+ ↔ Mg2+ + H2О.
2НBr + Mg ↔ MgBr2 + H2↑.
е) В хлорате калия атом хлора находится в своей степени окисления раной +5 (промежуточная степень окисления), поэтому с восстановителем, например, бромоводородом будет играть роль окислителя:
Электронные уравнения процессов:
Восстановитель 2|4|2Br-1 - 2e = Br20 процесс окисления
Окислитель 1|2|Cl+5 + 4e = Cl+1 процесс восстановления
4Br- + Cl+5 ↔ 2Br20 + Cl+.
4НBr + KClO3 ↔ 2Br2 + KClO + 2H2O.
Ответ: а1; в4; д1,3; е4.

